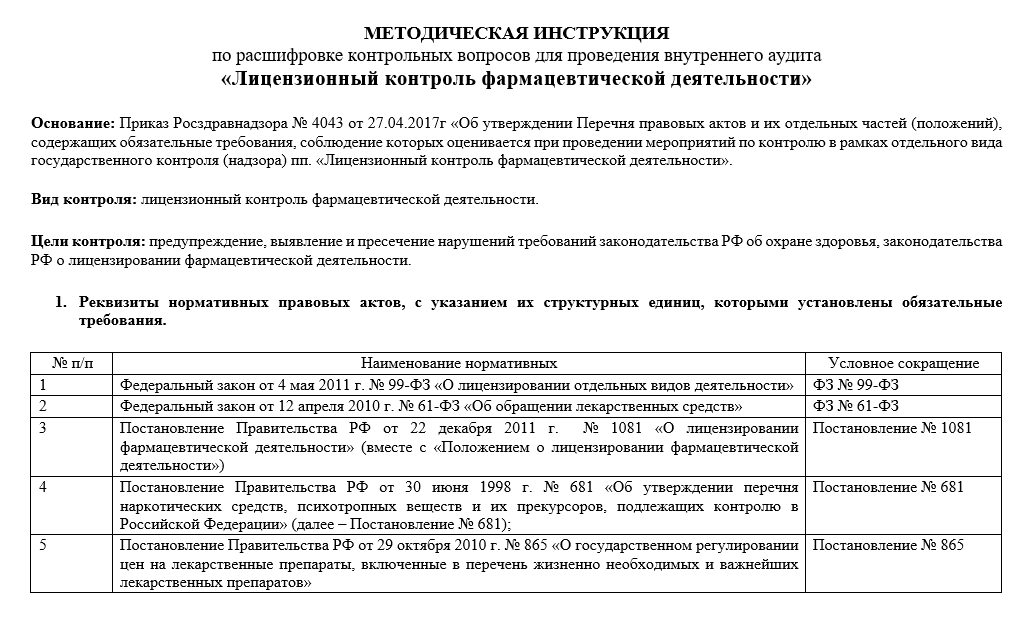
Содержание
Документы —
Правительство России
Варианты поиска по сайту
Закрыть
Следующая новость
Предыдущая новость
- Маленький размер шрифта
- Нормальный размер шрифта
- Большой размер шрифта
- Включить/выключить отображение изображений
Вкл
Выкл
Правительство России
- Демография
- Здоровье
- Образование
- Культура
- Общество
- Государство
- Занятость и труд
- Технологическое развитие
- Экономика.
 Регулирование
Регулирование - Финансы
- Социальные услуги
- Экология
- Жильё и города
- Транспорт и связь
- Энергетика
- Промышленность
- Сельское хозяйство
- Региональное развитие
- Дальний Восток
- Россия и мир
- Безопасность
- Право и юстиция
- Избранные документы со справками к ним
- Поиск по всем документам
Вид документа
Постановление Правительства Российской ФедерацииРаспоряжение Правительства Российской ФедерацииРаспоряжение Президента Российской ФедерацииУказ Президента Российской ФедерацииФедеральный законФедеральный конституционный законКодекс
Номер
Заголовок или текст документа
Дата подписания
2 ноября, среда
Постановление Правительства Российской Федерации от 02.
 11.2022 г. № 1958
11.2022 г. № 1958
О внесении изменений в Положение о Министерстве экономического развития Российской Федерации и признании утратившими силу некоторых актов Правительства Российской Федерации
1 ноября, вторник
Постановление Правительства Российской Федерации от 01.11.2022 г. № 1948
О представлении Президенту Российской Федерации для внесения на ратификацию Протокола о внесении изменений в Договор о Евразийском экономическом союзе от 29 мая 2014 года
Постановление Правительства Российской Федерации от 01.
 11.2022 г. № 1947
11.2022 г. № 1947
О порядке обеспечения соблюдения запрета на перемещение физическими лицами с территории Камчатского края воздушным транспортом в багаже и (или) ручной клади икры лососевых видов рыб (красной икры) непромышленного изготовления более 10 килограммов в расчете на одно физическое лицо за один рейс в период проведения эксперимента по внедрению дополнительных механизмов регулирования внутренних воздушных перевозок икры лососевых видов рыб (красной икры) непромышленного изготовления
31 октября, понедельник
Постановление Правительства Российской Федерации от 31.10.2022 г. № 1943
О внесении изменений в Правила предоставления субсидии из федерального бюджета автономной некоммерческой организации «Россия — страна возможностей» на проведение хакатонов по искусственному интеллекту по решению бизнес-проблем и социальных проблем, в том числе на основе государственных наборов данных, а также лекций по искусственному интеллекту
Постановление Правительства Российской Федерации от 31.
 10.2022 г. № 1940
10.2022 г. № 1940
Об утверждении требований к обращению побочных продуктов животноводства
Постановление Правительства Российской Федерации от 31.10.2022 г. № 1942
О внесении изменений в Положение о Правительственной комиссии по повышению устойчивости российской экономики в условиях санкций и Положение о подкомиссии по повышению устойчивости финансового сектора и отдельных отраслей экономики Правительственной комиссии по повышению устойчивости российской экономики в условиях санкций
29 октября, суббота
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1932
10.2022 г. № 1932
О внесении изменений в Инструкцию о порядке допуска должностных лиц и граждан Российской Федерации к государственной тайне
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1930
О внесении изменения в приложение № 3 к Правилам оптового рынка электрической энергии и мощности
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1926
О внесении изменения в приложение к постановлению Правительства Российской Федерации от 7 августа 2014 г. № 778
№ 778
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1927
Об утверждении Правил предоставления гранта в форме субсидии из федерального бюджета автономной некоммерческой организации «Дирекция спортивных и социальных проектов» в целях финансового обеспечения мероприятий, связанных с подготовкой и проведением в Российской Федерации проекта «Игры будущего» в 2024 году
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1925
О внесении изменений в Положение о федеральном государственном земельном контроле (надзоре) и Положение о федеральном государственном ветеринарном контроле (надзоре)
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1929
10.2022 г. № 1929
О внесении изменений в постановление Правительства Российской Федерации от 19 октября 2012 г. № 1069
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1936
О внесении изменений в Правила предоставления межбюджетных трансфертов из бюджета Федерального фонда обязательного медицинского страхования бюджетам территориальных фондов обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1923
10.2022 г. № 1923
Об утверждении Правил предоставления в 2022 году иных межбюджетных трансфертов, имеющих целевое назначение, из федерального бюджета бюджетам субъектов Российской Федерации и г. Байконура, источником финансового обеспечения которых являются бюджетные ассигнования из резервного фонда Правительства Российской Федерации, в целях софинансирования расходных обязательств субъектов Российской Федерации и г. Байконура по предоставлению межбюджетных трансфертов бюджетам территориальных фондов обязательного медицинского страхования на дополнительное финансовое обеспечение медицинской помощи, оказанной лицам, застрахованным по обязательному медицинскому страхованию, в рамках реализации территориальных программ обязательного медицинского страхования в 2021 — 2022 годах
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1933
10.2022 г. № 1933
Об особенностях предоставления некоторых мер социальной поддержки, а также оказания государственной социальной помощи на основании социального контракта семьям граждан, призванных на военную службу по мобилизации в Вооруженные Силы Российской Федерации
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1939
Об особенностях предоставления выплат, установленных Указом Президента Российской Федерации от 27 августа 2022 г. № 586 «О выплатах гражданам Донецкой Народной Республики, Луганской Народной Республики, Украины и лицам без гражданства, вынужденно покинувшим территории Донецкой Народной Республики, Луганской Народной Республики, Украины и прибывшим на территорию Российской Федерации»
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1937
10.2022 г. № 1937
О внесении изменений в Положение о системе управления государственными программами Российской Федерации
Постановление Правительства Российской Федерации от 29.10.2022 г. № 1938
О внесении изменений в Правила предоставления субсидий из федерального бюджета российским кредитным организациям и государственной корпорации развития «ВЭБ.РФ» на возмещение недополученных ими доходов по кредитам, выданным на цели реализации инвестиционных проектов на территориях Дальневосточного федерального округа и Арктической зоны Российской Федерации
Постановление Правительства Российской Федерации от 29.
 10.2022 г. № 1924
10.2022 г. № 1924
О представлении обязательной отчетности региональных регулируемых организаций
28 октября, пятница
Постановление Правительства Российской Федерации от 28.10.2022 г. № 1917
О внесении изменений в некоторые акты Правительства Российской Федерации
1
Показать еще
Минздрав подготовил изменения в положение о лицензировании фармдеятельности в России » Фармвестник
Лицензирование фармацевтической деятельности в России ждут изменения. Согласно предложениям Минздрава, теперь для получения лицензии соискатели смогут предоставлять свидетельства об аккредитации специалистов, а организациям оптовой торговли лекарствами не понадобятся данные о соответствии помещений требованиям санитарных правил.
Согласно предложениям Минздрава, теперь для получения лицензии соискатели смогут предоставлять свидетельства об аккредитации специалистов, а организациям оптовой торговли лекарствами не понадобятся данные о соответствии помещений требованиям санитарных правил.
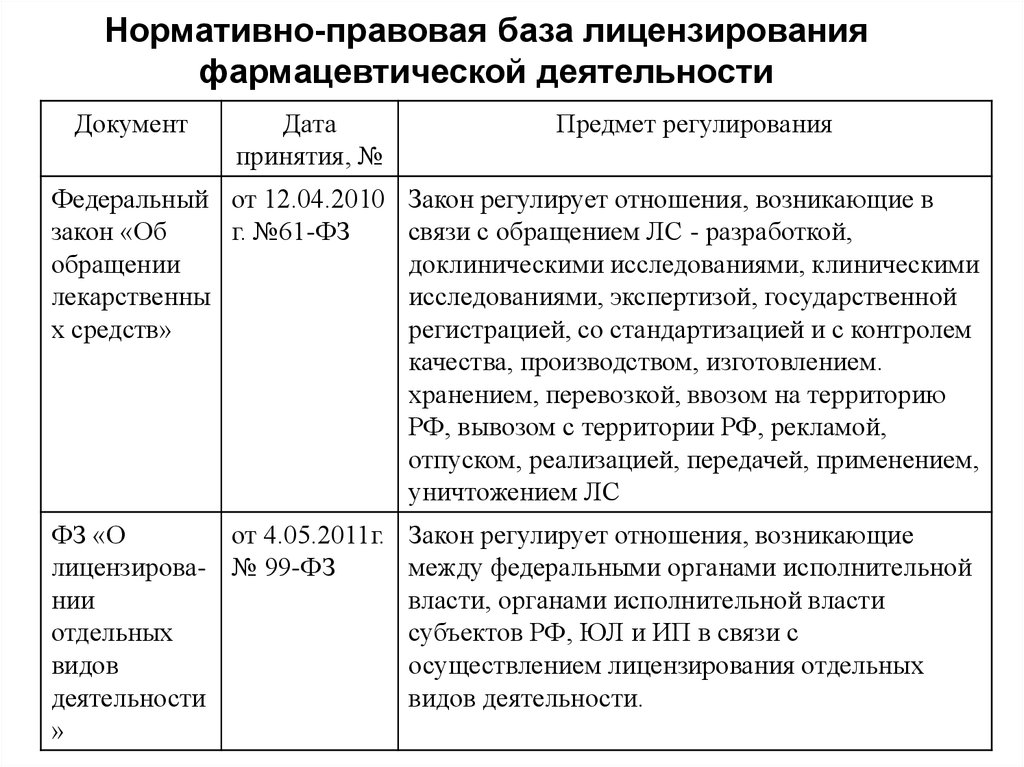
Минздрав подготовил проект постановления правительства об утверждении Положения о лицензировании фармацевтической деятельности в стране. Документ опубликован на портале regulation.gov.ru, он должен отменить аналогичное Постановление Правительства РФ № 1081 от 22.12.2011. Предполагается, что изменения вступят в силу в марте 2022 года и будут действовать шесть лет.
Согласно проекту положения, соискатели фармлицензии и лицензиаты (кроме медорганизаций) теперь должны будут иметь по месту фармдеятельности производственные объекты, технические средства, оборудование и документацию, принадлежащие им или другим лицензиатам, которые соответствуют ст.54 и ст.55 ФЗ № 61 «Об обращении лекарственных средств».
Кроме того, должны быть обеспечены надлежащее хранение и перевозка лекарств, дистрибьюторская практика препаратов ответственного лица за внедрение и обеспечение системы качества хранения и перевозки лекарственных средств и актуализация стандартных операционных процедур.
Для получения лицензии соискатель также должен будет предоставить сведения, подтверждающие наличие необходимых для фармдеятельности производственных объектов, технических средств, оборудования и документации, права на которые зарегистрированы или не зарегистрированы в ЕГРН.
Соискатель должен подтвердить и наличие лицензии долгосрочного договора о передаче на аутсорсинг работ, «составляющих фармацевтическую деятельность (в части хранения и реализации лекарственных средств для медицинского применения), заключенного с лицензиатом, осуществляющим фармацевтическую деятельность по адресу выполнения передаваемых на аутсорсинг соискателем лицензии работ (услуг) (для получения лицензии на оптовую торговлю лекарственными средствами)».
Организации оптовой торговли лекарственными средствами, получающие лицензию «на основании долгосрочного договора о передаче на аутсорсинг работ (услуг) в части хранения и реализации лекарственных средств для медицинского применения», смогут не предоставлять в органы данные о соответствии помещений требованиям санитарных правил.
В числе документов им также можно будет предоставлять свидетельства об аккредитации специалистов для обращения лекарств для медприменения, в том числе в обособленных подразделениях медорганизаций и для ветеринарного применения.
Для фармдеятельности по другому адресу, не указанному в лицензии, организациям оптовой торговли лекарствами нужно будет предоставить документы, подтверждающие «наличие долгосрочного договора о передаче на аутсорсинг работ (услуг), составляющих фармацевтическую деятельность (в части хранения и реализации лекарственных средств для медицинского применения), заключенного с иным лицензиатом, осуществляющим фармацевтическую деятельность по адресу выполнения передаваемых на аутсорсинг работ (услуг)».
В этом пункте также можно будет предоставить свидетельства об аккредитации специалистов, которые будут реализовывать лекарственные и ветеринарные препараты по указанному адресу.
При намерении выполнять новые работы и услуги организации оптовой торговли лекарствами должны указать сведения о наличии «долгосрочного договора о передаче на аутсорсинг работ (услуг), составляющих фармацевтическую деятельность (в части хранения и реализации лекарственных средств для медицинского применения), заключенного с лицензиатом, осуществляющим фармацевтическую деятельность по адресу выполнения передаваемых на аутсорсинг соискателем лицензии работ (услуг)». Сюда же также можно будет добавить свидетельства об аккредитации специалистов.
Сюда же также можно будет добавить свидетельства об аккредитации специалистов.
В проекте постановления указывается, что лицензирующие органы обязаны получать от соискателей лицензий и лицензиатов документы в электронном виде, а также сообщать им на своих сайтах о решениях по выдаче лицензий.
«В случае неработоспособности информационной системы актуальная информация из реестра лицензий должна быть размещена в сети «Интернет» после восстановления [ее] работоспособности , но не позднее 3 рабочих дней со дня внесения сведений в реестр лицензий», — говорится в документе.
Региональные власти должны будут вести реестр лицензий в информационной системе, оператором которой являются федеральные власти. «Выписка из реестра лицензий на бумажном носителе предоставляется за плату. Размер такой платы, порядок ее взимания, случаи и порядок возврата устанавливаются органом, определяющим государственную политику в сфере лицензирования. Выписка из реестра лицензий в форме электронного документа, подписанного усиленной квалифицированной электронной подписью лицензирующего органа, предоставляется без взимания платы», — отмечается в документе.
Фармацевтические федеральные правила и положения — StatPearls
Определение/Введение
Фармация охватывает исследования, производство, распространение, утилизацию и показания к применению любых лекарств или лекарств. Федеральное управление по лекарственным средствам (FDA) осуществляет надзор за распространением и, следовательно, за аптеками, в то время как правительства штатов и местные органы власти имеют некоторые полномочия в пределах своей юрисдикции. В то время как Конгресс имеет законодательные обязанности, FDA также может создавать и изменять правила. Это упражнение направлено на предоставление краткого обзора важных законодательных и нормативных актов, касающихся фармации.
Проблемы, вызывающие озабоченность
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) было основано в результате принятого Теодором Рузвельтом Закона о чистых пищевых продуктах и лекарствах (1906 г.), который запрещал неправильную маркировку, определяемую как вводящая в заблуждение и мошенническая маркировка пищевых продуктов и лекарств. Важно отметить, что Верховный суд постановил, что этот закон не запрещает ложные терапевтические утверждения, а только вводящие в заблуждение.[2]
Важно отметить, что Верховный суд постановил, что этот закон не запрещает ложные терапевтические утверждения, а только вводящие в заблуждение.[2]
Закон о пищевых продуктах, лекарствах и косметических средствах (1938 г.) заменил вышеупомянутое законодательство. Существенные различия включают повышенную строгость безопасности, криминализацию ложных терапевтических заявлений, требование к дистрибьюторам перечислять ингредиенты, показания и предупреждения; распространение на косметику и терапевтические устройства; и санкционирование проверок на фабриках. Это также снизило ставку возмещения расходов на медицинское оборудование длительного пользования.[3][4] Этот законодательный орган в настоящее время служит основной основой администрации с множеством поправок, перечисленных ниже.
Поправка Дарема-Хамфри разделила лекарства на два класса: рецептурные (Rx) и безрецептурные (OTC). FDA имеет право категоризировать. Лекарства, отпускаемые по рецепту, — это препараты, которые могут вызвать вредные привычки или нанести вред, если их использовать без наблюдения профессионала. Раньше производителям разрешалось определять категории лекарств. В случаях, когда производители не согласны с присвоенным классом, они могут подать дополнительную заявку, петицию или пройти процесс проверки. Лекарства, отпускаемые по рецепту, должны иметь федеральную маркировку. Поправка разрешила выдачу рецептурных лекарств по телефону.[5]
Раньше производителям разрешалось определять категории лекарств. В случаях, когда производители не согласны с присвоенным классом, они могут подать дополнительную заявку, петицию или пройти процесс проверки. Лекарства, отпускаемые по рецепту, должны иметь федеральную маркировку. Поправка разрешила выдачу рецептурных лекарств по телефону.[5]
Поправка Кефовера-Харриса была принята в связи с обнаружением постфактум тератогенного действия талидомида, что привело к рождению 10 000 детей с тяжелыми уродствами. Поправка обеспечивает современную основу для утверждения фармацевтических препаратов, которая включает следующее:
Открытие и доклинические испытания
Предложение о клинических испытаниях посредством заявки на получение нового лекарственного средства
Испытания фазы 1: наблюдение вредные эффекты в выборке от 20 до 100 здоровых людей
Испытания фазы 2: аналитическое исследование для оценки терапевтических свойств препарата на выборке от 100 до 500 пациентов, соответствующих предполагаемым показаниям
Испытания фазы 3: более крупное аналитическое исследование, подобное размер выборки от 1000 до 5000 пациентов
Общий период, когда спонсоры лекарств и FDA встречаются перед подачей заявки на новый лекарственный препарат (NDA)
Подача NDA
Период от 6 месяцев до 2 лет, когда FDA оценивает исследование спонсора лекарственного препарата
Одобрение или неутверждение лекарственного препарата FDA
Испытания фазы 4, в которых спонсоры лекарств проводят постмаркетинговый исследования.
 [6]
[6]
В то время как производители и исследовательские компании могут выбрать торговую марку, назначение непатентованных наименований осуществляется Советом по принятым именам США (USAN). Другие ассоциации, включая Американскую медицинскую ассоциацию (AMA), Американскую ассоциацию фармацевтов (APhA) и Фармакопейную конвенцию США, также играют роль коспонсоров. Имена являются неофициальными, пока не опубликованы в Федеральном реестре.[7]
Закон о внесении поправок в Закон о медицинских устройствах отличает медицинские устройства от фармацевтических препаратов как инструменты, не вызывающие химических реакций. Он классифицировал устройства на основе риска для пациентов по трем классам и предусматривал пропорциональную строгость рекомендаций по утверждению до распределения на основе указанного риска. FDA должно получать отчеты производителей о нежелательных явлениях. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов имеет право запретить продажу устройств на рынке, если это будет сочтено целесообразным. [8]
[8]
Комплексный закон о предотвращении злоупотребления наркотиками и борьбе с ними был принят при президенте Никсоне в рамках его войны с наркотиками. Этот закон создал Управление по борьбе с наркотиками (DEA) и регулировал классификацию, закупку, распространение, назначение и регистрацию лекарств. Наркотики классифицируются на основе показаний к применению и потенциальных злоупотреблений, приведенных в Таблице I.
Таблица I: Классификация, распределение и примеры контролируемых веществ
Рецепт на препараты Списка II должен быть письменным или электронным, если только он не выдается профессионалом непосредственно пользователю или в экстренных ситуациях. Исправления не допускаются; в сценариях с неверной информацией необходимо выдать новый рецепт. Рецепт на лекарства Списков III-V может быть устным, письменным или электронным. Передача Списков I и II требует подачи формы DEA 222 и должна быть передана уполномоченному лицу, зарегистрированному в DEA. Текущее руководство поощряет использование Системы заказа контролируемых веществ (CSOS), электронного эквивалента, который повышает точность, оборот и возможности управления запасами. Передача препаратов из Списков III – V ограничена; в день допускается только одна передача, если две аптеки не используют общую базу данных в реальном времени. Любые оставшиеся пополнения должны быть обработаны в аптеке, в которую они были переданы. При передаче должно быть написано слово VOID в тех случаях, когда рецепт был на бумаге, и должна быть записана информация о другой аптеке, включая номер учреждения DEA и имя принимающего фармацевта. Также следует проверить пустоты в системе. Для уничтожения любых списков контролируемых веществ требуется заполнение формы DEA 41.
Передача препаратов из Списков III – V ограничена; в день допускается только одна передача, если две аптеки не используют общую базу данных в реальном времени. Любые оставшиеся пополнения должны быть обработаны в аптеке, в которую они были переданы. При передаче должно быть написано слово VOID в тех случаях, когда рецепт был на бумаге, и должна быть записана информация о другой аптеке, включая номер учреждения DEA и имя принимающего фармацевта. Также следует проверить пустоты в системе. Для уничтожения любых списков контролируемых веществ требуется заполнение формы DEA 41.
В случае значительной потери контролируемых веществ аптеки должны уведомить DEA в письменной форме через Форму 106 в течение рабочего дня. Примечательно, что уровень «значимости» не указан. В то время как обо всех кражах необходимо сообщать, пропавшие вещества из-за поврежденного или утерянного продукта не требуют процедуры.
Сводный закон о примирении улучшил взаимодействие между аптекой и пациентом и улучшил результаты за счет более тщательной оценки перед назначением лекарства с целью снижения затрат. Алгоритмы обнаруживают потенциальные проблемы с лекарствами, включая, помимо прочего, терапевтическое дублирование, возможные лекарственные взаимодействия, противопоказания, неправильную дозу или продолжительность и аллергии. Однако это позволяет фармацевтам принимать окончательное решение. В каждом штате также должны быть местные стандарты консультирования пациентов по поводу лекарств. Это также повысило качество базы данных, поощряя фармацевтов получать, записывать и хранить информацию о пациентах Medicaid для улучшения результатов в отношении здоровья. Таким образом, он установил минимальный стандарт обслуживания для всех учреждений, нуждающихся в финансировании Medicare. Важно отметить, что, хотя основной целью Закона были пациенты Medicaid, те же стандарты применяются и к пациентам, не получающим Medicaid.[10]
Алгоритмы обнаруживают потенциальные проблемы с лекарствами, включая, помимо прочего, терапевтическое дублирование, возможные лекарственные взаимодействия, противопоказания, неправильную дозу или продолжительность и аллергии. Однако это позволяет фармацевтам принимать окончательное решение. В каждом штате также должны быть местные стандарты консультирования пациентов по поводу лекарств. Это также повысило качество базы данных, поощряя фармацевтов получать, записывать и хранить информацию о пациентах Medicaid для улучшения результатов в отношении здоровья. Таким образом, он установил минимальный стандарт обслуживания для всех учреждений, нуждающихся в финансировании Medicare. Важно отметить, что, хотя основной целью Закона были пациенты Medicaid, те же стандарты применяются и к пациентам, не получающим Medicaid.[10]
Закон о модернизации Medicare радикально изменил систему Medicare с момента ее создания. Он предоставляет систему добровольного страхования, в которой правительство помогает финансировать расходы на рецептурные препараты в ситуациях, когда стоимость высока или пациенты испытывают финансовые трудности. В отношении дорогостоящих рецептов проводятся ежегодные обзоры назначенных лекарств, чтобы найти способы снизить затраты, свести к минимуму потенциальное взаимодействие с лекарствами и выявить другие потенциальные проблемы. Пациенты, участвующие в программе, могут делать сбережения на безналоговом сберегательном счете. Хотя добровольно, здоровые люди, которые решают не соглашаться, могут быть оштрафованы.[11]
В отношении дорогостоящих рецептов проводятся ежегодные обзоры назначенных лекарств, чтобы найти способы снизить затраты, свести к минимуму потенциальное взаимодействие с лекарствами и выявить другие потенциальные проблемы. Пациенты, участвующие в программе, могут делать сбережения на безналоговом сберегательном счете. Хотя добровольно, здоровые люди, которые решают не соглашаться, могут быть оштрафованы.[11]
Помимо FDA, над фармацевтикой наблюдают и другие регулирующие органы.
Закон об упаковке для предотвращения отравления от 1970 г., принятый Комиссией по безопасности потребительских товаров, требует использования недоступной для детей упаковки для предметов домашнего обихода и специальных упаковок для лекарств. Для пациентов, которым трудно открывать указанные упаковки, возможны запросы на небезопасные для детей упаковки. Другие исключения включают лекарства для неотложной помощи.
Конгресс принял закон о маркетинге отпускаемых по рецепту лекарств, чтобы гарантировать качество лекарств для американских потребителей, в частности, против фальсификации, подделки, неправильного обозначения, недостаточной активности и истечения срока годности. Он предотвращает реимпорт наркотиков кем-либо, кроме производителей, которые когда-то экспортировались; это произошло в результате открытия альтернативных рынков фармацевтических препаратов. Это также усилило строгость продаж и распространения фармацевтических препаратов: оптовые розничные торговцы должны получить специальные лицензии; образцы доступны только по запросу лицензированного врача.
Он предотвращает реимпорт наркотиков кем-либо, кроме производителей, которые когда-то экспортировались; это произошло в результате открытия альтернативных рынков фармацевтических препаратов. Это также усилило строгость продаж и распространения фармацевтических препаратов: оптовые розничные торговцы должны получить специальные лицензии; образцы доступны только по запросу лицензированного врача.
Клиническое значение
Медицинские работники должны пройти регистрацию контролируемых веществ в Управлении по борьбе с наркотиками (DEA), и им будет присвоен номер. Важно отметить, что, поскольку функции фармацевтических представителей не распространяются на назначение или введение лекарств, им не требуется номер DEA.[9] Они должны знать о разных законах, чтобы следовать передовой клинической практике и соблюдать рекомендации. Невыполнение этого требования может привести к неблагоприятным последствиям для пациента, общества и самого себя.[13]
Ссылки
- 1.
Флеминг Т.
 Р., Деметс Д.Л., Макшейн Л.М. Обсуждение: Роль, положение и функции FDA — прошлое, настоящее и будущее. Биостатистика. 2017 01 июля; 18 (3): 417-421. [Бесплатная статья PMC: PMC5862299] [PubMed: 28633307]
Р., Деметс Д.Л., Макшейн Л.М. Обсуждение: Роль, положение и функции FDA — прошлое, настоящее и будущее. Биостатистика. 2017 01 июля; 18 (3): 417-421. [Бесплатная статья PMC: PMC5862299] [PubMed: 28633307]- 2.
ID Баркана. Промышленность требует регулирования: принятие Закона о чистых продуктах питания и лекарствах 1906 года. Am J Public Health. 1985 г., январь; 75 (1): 18–26. [Бесплатная статья PMC: PMC1646146] [PubMed: 3881052]
- 3.
НОВЫЙ ФЕДЕРАЛЬНЫЙ ЗАКОН О ПРОДУКТАХ ПРОДОВОЛЬСТВИЯ, ЛЕКАРСТВ И КОСМЕТИКИ. Кал Вест Мед. 1938 г., август; 49 (2): 172–174. [Бесплатная статья PMC: PMC1659596] [PubMed: 18744678]
- 4.
Stern AD. Инновации в условиях неопределенности регулирования: данные медицинских технологий. J Государственная экономика. 2017 Январь; 145: 181-200. [Бесплатная статья PMC: PMC5482535] [PubMed: 28652646]
- 5.
Донохью Дж. История рекламы лекарств: меняющаяся роль потребителей и защита прав потребителей.
 Милбэнк К. 2006; 84 (4): 659-99. [PMC бесплатная статья: PMC26
Милбэнк К. 2006; 84 (4): 659-99. [PMC бесплатная статья: PMC26] [PubMed: 17096638] - 6.
Грин Дж.А., Подольский С.Х. Реформа, регулирование и фармацевтика — поправки Кефовера-Харриса на 50. N Engl J Med. 2012 18 октября; 367 (16): 1481-3. [Бесплатная статья PMC: PMC4101807] [PubMed: 23075174]
- 7.
ZUKOSKI CF. ПРОЦЕДУРЫ И ПРИНЦИПЫ СОВЕТА США. ДЖАМА. 1965, 22 марта; 191:1019-21. [PubMed: 14257730]
- 8.
Schlauderaff A, Boyer KC. Обзор законодательства о медицинских устройствах Управления по санитарному надзору за качеством пищевых продуктов и медикаментов и его взаимосвязь с современной медицинской практикой. Куреус. 201909 мая;11(5):e4627. [PMC бесплатная статья: PMC6615584] [PubMed: 31312553]
- 9.
Габай М. Федеральный закон о контролируемых веществах: графики и регистрация аптек. Хосп Фарм. 2013 июнь; 48 (6): 473-4. [Бесплатная статья PMC: PMC3839489] [PubMed: 24421507]
- 10.

Келли М. Сводный закон о сверке бюджета 1987 года. Анализ политики. Нурс Клин Норт Ам. 1989 сен; 24 (3): 791-4. [PubMed: 2671955]
- 11.
Мегеллас ММ. Модернизация Medicare: новая льгота на лекарства, отпускаемые по рецепту, и переработанная часть B и часть C. Proc (Bayl Univ Med Cent). 2006 Январь; 19 (1): 21-3. [Статья PMC бесплатно: PMC1325278] [PubMed: 16424927]
- 12.
Humphrey N. U.S. Комиссия по безопасности потребительских товаров. J Педиатр Здравоохранение. 1990 ноябрь-декабрь;4(6):323-4. [PubMed: 2250222]
- 13.
Веселый А.Ф. Как закон распознает и рассматривает медицинские ошибки? JR Soc Med. 2009 июль; 102 (7): 265-71. [Бесплатная статья PMC: PMC2711199] [PubMed: 19605857]
Отдел фармацевтического контроля | дох
УВЕДОМЛЕНИЕ О ЗАДЕРЖКАХ ДОСТАВКИ
DC Health испытывает задержки с доставкой почты из-за влияния COVID-19 на почтовую службу США.

Мы благодарим вас за терпение, поскольку мы продолжаем обрабатывать всю почту настолько своевременно, насколько это возможно.
***ОБНОВЛЕНИЯ О COVID-19***
ЦЕНТР ОБРАБОТКИ Часы работы:
Администрация по регулированию и лицензированию здравоохранения (HRLA) Центр обработки открыт для публики в понедельник, вторник, четверг и пятницу, с 9:00 до 13:00 и в среду с 9:00 до 3:00. :30 (кроме выходных).
COVID-19 Руководство и передовой опыт
Для получения самой последней информации о мерах округа по борьбе с COVID-19, включая информацию о передовом опыте, отказах от лицензирования и рекомендуемых руководствах, перейдите по ссылке коронавирус.dc.gov .
В связи с продолжающимися усилиями по борьбе с распространением COVID-19, вступающими в силу немедленно, Управление по санитарному надзору и лицензированию (HRLA) реализует политику 100% дистанционной работы.

Физические лица также могут позвонить в Центр обработки по телефону 1 (877) 672-2174 , чтобы получить обновленную информацию о своем заявлении, находящемся на рассмотрении.
В связи с продолжающейся пандемией COVID-19 все заседания Совета медицинских работников в настоящее время проводятся виртуально. Пожалуйста, проверьте соответствующий веб-сайт каждого совета для получения информации о том, когда состоится следующее собрание.
Если вы уже связались со специалистом по лицензированию медицинских услуг (HLS), отправьте ему любые документы по электронной почте.
*Обновление почтового адреса Отдела фармацевтического контроля*
ВСТУПИЛ В СИЛУ НЕМЕДЛЕННО Заявители должны подать все заявки на учреждение в офис Отдела фармацевтического контроля, расположенный по адресу:
899 North Capitol Street, NE0 0 Washington DC 2 0 Floor
First1, 901Все заявки на обслуживание, за исключением обновлений аптек, по-прежнему оформляются в бумажном виде и должны быть отправлены по почте в Отдел фармацевтического контроля.

Заявки на объекты включают:
- Новые и обновленные приложения DM (производитель, дистрибьютор, оптовик)
- Новые и обновленные заявки на регистрацию контролируемых веществ для объектов DM
- Новые аптечные приложения
- Новые заявки на регистрацию контролируемых веществ для аптек
- Изменение названия, местонахождения и владельца объектов DM (и их соответствующих регистраций контролируемых веществ) требует новой заявки. После одобрения действующая лицензия будет закрыта, и будет выдана новая лицензия.
Отказ от лицензирования
В ответ на COVID-19 DC Health отменила все лицензионные требования для практикующих врачей, имеющих лицензию с хорошей репутацией в другой юрисдикции. Подробнее о процессе отказа можно прочитать ЗДЕСЬ.
Если вам требуется помощь от Совета фармации/отдела фармацевтического контроля, свяжитесь со следующими лицами по электронной почте:
Сервис
Персонал
Адрес электронной почты
Лицензия на объект/регистрация контролируемых веществ
(Аптеки для резидентов и нерезидентов, оптовый торговец лекарствами для резидентов и нерезидентов, производитель и дистрибьютор)
Мисс Сабрина Льюис
Г-жа ЛаХуан Джеффрис-Джонсон
[электронная почта защищена]
[электронная почта защищена]
Лицензия/регистрация практикующего врача
(фармацевт, стажер-фармацевт, специалист по фармацевтике, техник аптеки)
Мисс Карин Бэррон
Мисс Луэнн Гринуэй
[электронная почта защищена]
[электронная почта защищена]
(новый) Регистрация веществ, контролируемых практикующими врачами,
Мисс Леатрис Ли [электронная почта защищена]
(Обновление) Регистрация контролируемых медицинских препаратов
Мисс Карин Бэррон
Мисс Луэнн Гринуэй
Г-жа ЛаХуан Джеффрис-Джонсон
Мисс Сабрина Льюис
Мисс Леатрис Ли
[электронная почта защищена]
[электронная почта защищена]
[электронная почта защищена]
[электронная почта защищена]
[электронная почта защищена]
Отдел фармацевтического контроля отвечает за ежегодные лицензионные проверки, надзор и мониторинг деятельности в учреждениях, которые закупают, распределяют, отпускают и управляют прописанными/рецептурными препаратами для продажи или использования потребителями в округе Колумбия.
 . Регулируемые объекты включают в себя; аптеки, больницы, программы лечения наркомании, исследователи, местные оптовые торговцы, дистрибьюторы, учреждения долгосрочного ухода, клиники для животных, центры диализа и амбулаторные хирургические центры.
. Регулируемые объекты включают в себя; аптеки, больницы, программы лечения наркомании, исследователи, местные оптовые торговцы, дистрибьюторы, учреждения долгосрочного ухода, клиники для животных, центры диализа и амбулаторные хирургические центры.Отдел фармацевтического контроля обеспечивает соблюдение всех окружных и федеральных законов и постановлений об аптеках (аптеки, контролируемые вещества, замена рецептов, чистота лекарств, законы о распространении и производстве лекарств и сопутствующие постановления и т. д.).
Отдел фармацевтического контроля служит связующим звеном между правительством округа и федеральными агентствами (например, Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, Управлением по борьбе с наркотиками, Службой здравоохранения и социальных служб, Агентством по защите прав потребителей и т. д.), занимаясь вопросами нормативного контроля.
Отдел фармацевтического контроля проводит расследования и консультирует все учреждения и программы, предоставляющие фармацевтическую продукцию и услуги жителям округа Колумбия.


 Регулирование
Регулирование [6]
[6] Р., Деметс Д.Л., Макшейн Л.М. Обсуждение: Роль, положение и функции FDA — прошлое, настоящее и будущее. Биостатистика. 2017 01 июля; 18 (3): 417-421. [Бесплатная статья PMC: PMC5862299] [PubMed: 28633307]
Р., Деметс Д.Л., Макшейн Л.М. Обсуждение: Роль, положение и функции FDA — прошлое, настоящее и будущее. Биостатистика. 2017 01 июля; 18 (3): 417-421. [Бесплатная статья PMC: PMC5862299] [PubMed: 28633307] Милбэнк К. 2006; 84 (4): 659-99. [PMC бесплатная статья: PMC26
Милбэнк К. 2006; 84 (4): 659-99. [PMC бесплатная статья: PMC26


 . Регулируемые объекты включают в себя; аптеки, больницы, программы лечения наркомании, исследователи, местные оптовые торговцы, дистрибьюторы, учреждения долгосрочного ухода, клиники для животных, центры диализа и амбулаторные хирургические центры.
. Регулируемые объекты включают в себя; аптеки, больницы, программы лечения наркомании, исследователи, местные оптовые торговцы, дистрибьюторы, учреждения долгосрочного ухода, клиники для животных, центры диализа и амбулаторные хирургические центры.