Содержание
Как Проверить Компанию На Долги?
Проверить ООО на долги можно в онлайн-сервисе ФССП. Для этого достаточно указать наименование, адрес и регион организации. Исполнительное производство начинается по решению суда.
Проверить задолженность юридического лица по ИНН можно с помощью сервиса на сайте ФНС России nalog.ru, регистрации для этого не потребуется:
- Зайдите на страницу сервиса проверки.
- Введите ИНН компании в поле «Параметры поиска».
Как узнать задолженность юридического лица?
Проверить задолженность юридического лица можно на сайте ФНС (nalog.ru). Для получения информации вам необходимо зарегистрировать личный кабинет пользователя, а также указать наименование организации и ее ИНН.
Как проверить есть ли долги на ооо?
Проверьте долг по ИНН одним из способов:
- На портале Госуслуг Проверить долги по налогам можно на портале Госуслуг.

- Через личный кабинет налогоплательщика на сайте nalog.ru. Если у вас есть личный кабинет налогоплательщика на сайте nalog.ru, бумажные уведомления по почте приходить не будут.
- В мобильном приложении Госуслуг
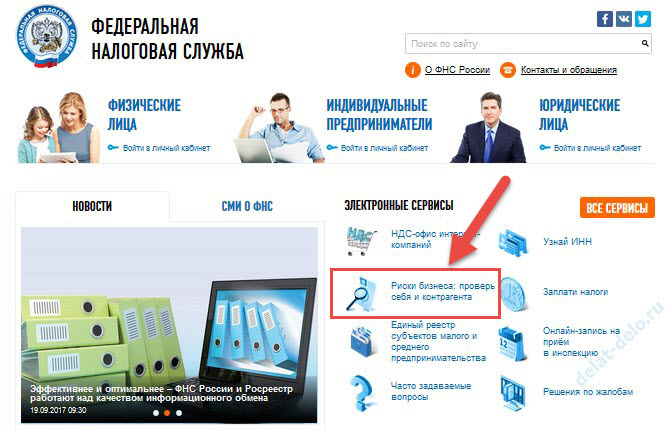
Как проверить компанию на честность?
Для проверки контрагента на надежность и добросовестность можно использовать такие сервисы:
- заказать выписку из ЕГРЮЛ на сайте ФНС;
- заказать выписку из ЕГРН на сайте Росреестра;
- проверить сведения через сервис «Прозрачный бизнес»;
- проверить юридический адрес на массовость;
- проверить директора на дисквалификацию;
Как бесплатно проверить контрагента?
На портале ЗАЧЕСТНЫЙБИЗНЕС, Вы можете бесплатно проверить Контрагента ЮЛ или ИП по информации из официальных открытых источников (ФНС, РОССТАТ, Арбитражный суд и д.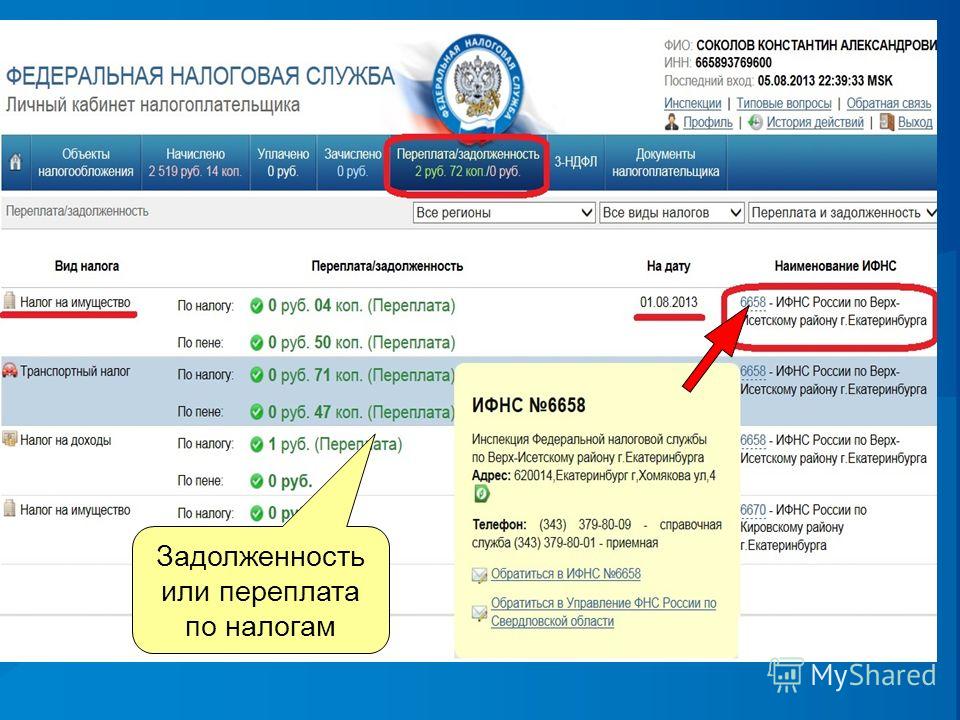 р.) Данные на портале ежедневно обновляются и синхронизируются с сервисом nalog.ru ФНС РФ*. Для этого введите в поисковой строке ИНН или ОГРН компании.
р.) Данные на портале ежедневно обновляются и синхронизируются с сервисом nalog.ru ФНС РФ*. Для этого введите в поисковой строке ИНН или ОГРН компании.
Как узнать сумму непогашенной задолженности?
Если вы допускаете, что у вас есть непогашенный долг, или вы хотите убедиться в его отсутствии, на сайте ФССП вы можете воспользоваться бесплатным онлайн-сервисом «Банк данных исполнительных производств „Узнай о своих долгах“».
Как узнать задолженность по налогам по ИНН Казахстан?
Услуги к оплате. Госуслуги, штрафы, налоги
В мобильном приложении Kaspi.kz перейдите в раздел «Госуслуги» → «Налоги» и выберите услугу «Долги по налогам». Введите ИИН и нажмите «Проверить». Если у вас есть задолженности, откроется список с информацией о каждой из них: вид налога, сумма долга, пеня.
Как узнать есть ли у меня ооо?
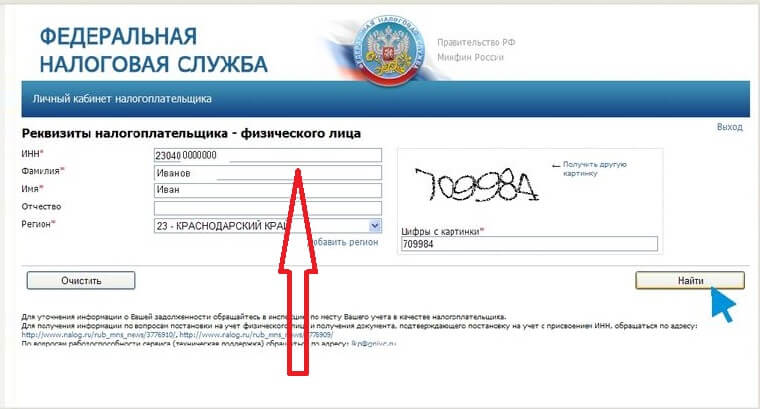
Первое, что нужно сделать – зайти на сайт egrul. nalog.ru, создать запрос по ИНН или ОГРН. В результате вы получите выписку из ЕГРЮЛ. Одним из пунктов отчета будет «Сведения о состоянии юридического лица». Он позволяет установить, существовала ли фирма, и действует ли она сейчас.
nalog.ru, создать запрос по ИНН или ОГРН. В результате вы получите выписку из ЕГРЮЛ. Одним из пунктов отчета будет «Сведения о состоянии юридического лица». Он позволяет установить, существовала ли фирма, и действует ли она сейчас.
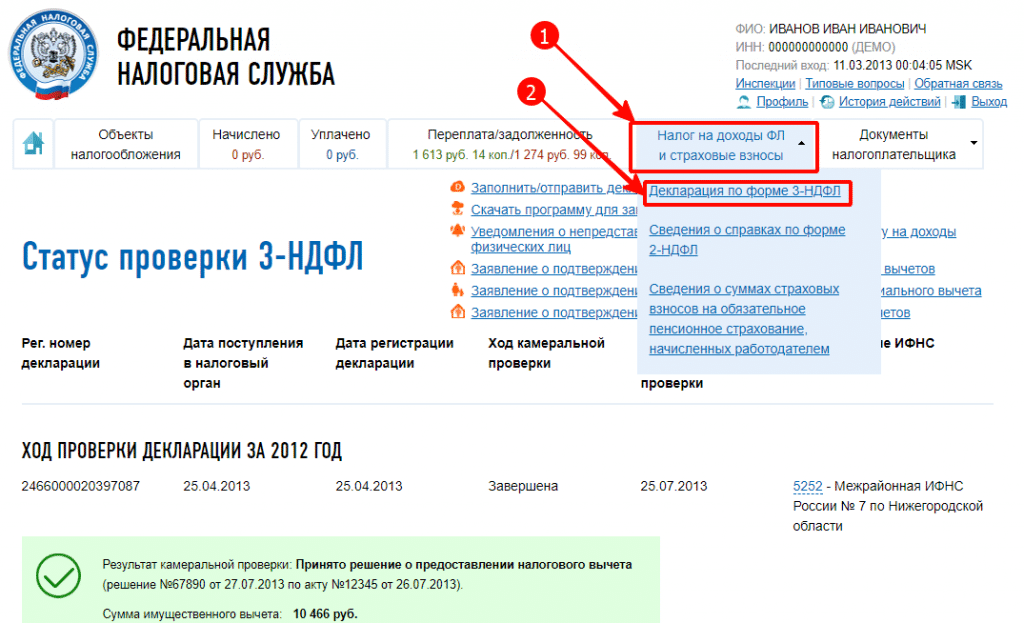
Как заказать справку о состоянии расчетов по налогам?
Через “Личный кабинет” Вы можете получить справку о состоянии расчетов по налогам, сборам, страховым взносам, пеням, штрафам, процентам, пройдя несколько этапов. Федеральной налоговой службы www.nalog.ru, предварительно получив пароль в налоговой инспекции.
Как получить справку об отсутствии задолженности юр лица?
Кто выдает и когда необходима Справку об отсутствии задолженности по налогам выдают налоговые инспекции. Чтобы ее получить, нужно обратиться в инспекцию по месту регистрации с заявлением. Его можно подать при личном визите в налоговую, через интернет или отправить почтой.
Как узнать кто владелец компании?
КАК УЗНАТЬ КТО ВЛАДЕЛЕЦ ФИРМЫ (ФАКТИЧЕСКИЙ)’СВЕДЕНИЯ ИЗ ЕГРЮЛ БЕСПЛАТНО’
- Заходим на сайт Федеральной налоговой службы по адресу www.
 egrul.nalog.ru.
egrul.nalog.ru. - В указанном месте вводим ОГРН или ИНН
- Вводим цифры с картинки
- Жмём найти
Как определить надежность компании?
Проверить контрагента и получить основную информацию о компании и руководителях можно, в первую очередь, через сервисы ФНС России. Данные о компании, которые можно проверить на сайте ФНС РФ: Сведения из ЕГРЮЛ о любом юр. лице.
На каком сайте проверить контрагента?
Сайты для официальной проверки контрагентов из базы ФНС с онлайн выгрузкой
| Сайт | Что можно проверить |
|---|---|
| fssprus.ru/iss/ip | Долги, которые взыскивают приставы, их суммы |
| kad.arbitr.ru | Судебные дела контрагента |
| gks.ru/accounting_report | Бухгалтерская отчетность, прибыль, убытки |
| e-disclosure.ru | Отчеты и документы АО, показатели их работы |
Где можно проверить добросовестность поставщика?
Проверка поставщика по ИНН
- Сайт Федеральной Налоговой службы — получение выписки из ЕГРЮЛ.
 Данные справки отображают действительные реквизиты компании, данные об уставном капитале и дату регистрации контрагента в ЕГРЮЛ.
Данные справки отображают действительные реквизиты компании, данные об уставном капитале и дату регистрации контрагента в ЕГРЮЛ. - Сайт Арбитражного суда России – позволит выявить наличие исков по отношению к контрагенту.
Как получить выписку из ЕГРЮЛ через интернет бесплатно?
«Как получить выписку из ЕГРЮЛ / ЕГРИП через интернет бесплатно?» — пошаговая инструкция
- Завершить процедуру регистрации на сайте nalog.ru.
- Авторизироваться (ввести логин и выбранный пароль)
- Перейти в раздел сайта ФНС, где реализован сервис подачи запроса
- Отправить сформированное заявление на выписку из ЕГРЮЛ / ЕГРИП
Как проверить контрагента в Казахстане?
Официальные сервисы для проверки контрагентов из Казахстана
- Портал государственных закупок.
- Реестр юридических лиц государства Казахстан.
- Реестр должников, которые фигурируют в исполнительных производствах.

- Список потенциально надежных поставщиков.
- Национальный Банк Казахстана.
- Реестр государственных предприятий.
Налоговая инспекция 33
Телефон налоговой
Время работы
Отзывы
ИФНС 33
Начальник Инспекция ФНС России № 33:
Толстова Татьяна Алексеевна
Фактический адрес:
125373, г. Москва, Походный проезд, домовладение 3
Юридический адрес:
125373, г. Москва, Походный проезд, домовладение 3
Адрес для почтовых отправлений:
125373, г. Москва, Походный проезд, домовладение 3
Услуги налоговой инспекции ИФНС 33: | |
Заказать выписку в ИФНС 33 (ЕГРЮЛ или ЕГРИП) | |
Зарегистрировать ИП в ИФНС 33 | |
Ликвидировать (закрыть) ИП в ИФНС 33 | |
Зарегистрировать ООО в ИФНС 33 | |
Получить справку в ИФНС 33 (о счетах, о задолжности и т. |
Схема проезда до налоговой инспекции:
Cпособ проезда:
метро «Тушинская», авт. 266, 2, 210 до ост. «платформа «Трикотажная» и далее пешком назад 100 метров и по Походному проезду — 400 метров, авт. 88 ,777 до ост. «ул. Василия Петушкова» и далее -200 метров;
метро «Сходненская», авт. 199, 678 до ост. «Походный проезд» и далее пешком 200 метров
Телефоны:
Секретарь:
8 (495) 400-00-33;
Справочная:
8 (495) 400-28-54;
Информирование по исчислению и уплате транспортрного налога и налога на имущество физических лиц:
8 (495) 400-28-16;
8 (495) 400-28-29;
Информирование по налоговым вычетам (социальный, имущественный):
8 (495) 400-28-14;
8 (495) 400-28-78;
Факс:
8 (495) 400-28-21;
Отдел | Телефон |
|---|---|
Отдел работы с налогоплательщиками | 8 (495) 400-28-61; |
Отдел регистрации и учета налогоплательщиков | 8 (495) 400-28-33; |
Отдел заказа выписки | подробнее… |
Отдел урегулирования задолженности | 8 (495) 400-28-34; |
Отдел ввода и обработки данных | 8 (495) 400-28-32; |
Отдел камеральных проверок №1 по вопросам исчисления и уплаты налога по УСН и налога на имущество организаций | 8 (495) 400-28-04; |
Отдел камеральных проверок №2 по вопросам исчисления и уплаты налога на прибыль организаций | 8 (495) 400-28-27; |
Отдел камеральных проверок №3 по вопросам исчисления и уплаты налога на добавленную стоимость | 8 (495) 400-28-26; |
Отдел камеральных проверок №4 по вопросам налогообложение индивидуальных предпринимателей и физических лиц (3-НДФЛ) | 8 (495) 400-28-78; |
Отдел камеральных проверок №5 по вопросам исчисления и уплаты транспортного налога и налога на имущество физических лиц | 8 (495) 400-28-31; |
Реквизиты
ИНН 7733053334
КПП 773301001
Код налогового органа в ФНС 33: 7733
Получатель: Управление Федерального казначейства по г.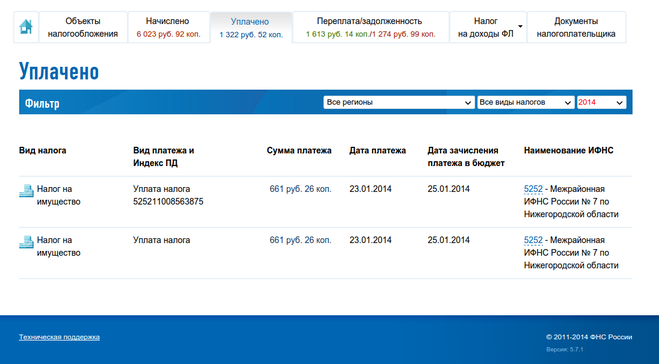 Москве (ИФНС России №33 по г. Москве)
Москве (ИФНС России №33 по г. Москве)
Наименование банка: ГУ Банка России по ЦФО
Номер счета: 40101810045250010041
БИК банка: 044525000
Номер корреспондентского счета или субсчет банка в котором открыт счет УФК России по г. Москве – нет
| Время pa6oты ИФНС: | Пepepыв: | |
пн: | 9.00-18.00 | 13.00-13.45 |
вт: | 9.00-18.00 | 13.00-13.45 |
cp: | 9.00-18.00 | 13.00-13.45 |
чт: | 9. 00-18.00 00-18.00 | 13.00-13.45 |
пт: | 9.00-16.45 | 13.00-13.45 |
Прием налогоплательщиков в операционном зале осуществляется без перерыва на обед понедельник, среда с 9.00 до 18.00; | ||
Выдача готовых выписок из ЕГРЮЛ/ЕГРИП При доставке выписки из ЕГРЮЛ/ЕГРИП, время согласовывается отдельно. | ||
<< Назад к списку ИФНС Москвы
Если Вы заметили на сайте опечатку или неточность, выделите её |
Семейство интерферонов (ИФН) — Creative Diagnostics
Обзор
Интерфероны (ИФН) представляют собой группу сигнальных белков, вырабатываемых и высвобождаемых клетками-хозяевами в ответ на присутствие нескольких патогенов, таких как вирусы, бактерии, паразиты и опухолевые клетки. В типичном сценарии инфицированная вирусом клетка высвобождает интерфероны, заставляя близлежащие клетки усиливать свою противовирусную защиту.
В типичном сценарии инфицированная вирусом клетка высвобождает интерфероны, заставляя близлежащие клетки усиливать свою противовирусную защиту.
ИФН принадлежат к большому классу белков, известных как цитокины/молекулы, которые используются для связи между клетками, запуская защитную защиту иммунной системы, помогающую уничтожать патогены. Интерфероны названы в честь их способности «вмешиваться» в репликацию вируса, защищая клетки от вирусных инфекций. IFN также выполняют различные другие функции: они активируют иммунные клетки, такие как естественные клетки-киллеры и макрофаги; они повышают защиту хозяина за счет усиления презентации антигена за счет увеличения экспрессии антигенов главного комплекса гистосовместимости (MHC). Некоторые симптомы инфекций, такие как лихорадка, мышечная боль и «гриппоподобные симптомы», также вызваны продукцией интерферонов и других цитокинов.
Члены IFN
У животных, включая человека, идентифицировано более двадцати различных генов и белков IFN. Обычно их делят на три класса: IFN I типа, IFN II типа и IFN III типа. ИФН, принадлежащие ко всем трем классам, важны для борьбы с вирусными инфекциями и для регуляции иммунной системы.
Обычно их делят на три класса: IFN I типа, IFN II типа и IFN III типа. ИФН, принадлежащие ко всем трем классам, важны для борьбы с вирусными инфекциями и для регуляции иммунной системы.
Таблица 1. Продукты, относящиеся к семейству ИФН
| ИФН типа I | ИФН-α | IFNA1 | IFNA2 |
| IFNA3 | IFNA4 | IFNA5 | |
| IFNA6 | IFNA7 | IFNA8 | |
| IFNA10 | IFNA13 | IFNA14 | |
| IFNA16 | IFNA17 | IFNA21 | |
| IFNB1 | IFNE | IFNK | |
| IFNW1 | IFNZ | ||
| IFNS Тип II | IFNG | ||
| IFNs Type III | IFNL1 / IL29 | IFNL2 / IL28A | IFNL3 / IL28B |
| IFNs Receptors | IFNAR1 | IFNAR2 | IFNGR1 |
| IFNGR2 | IFNLR1 | IL10RB |
Тип IFFERON Type I
ВСЕ IFN SIVESTSERSTTOR IF-COMPTOR IF-IFS IFNS IFN SIVESTTOR IF-IFS IFN IFNS IFNS IFNS IFNS IFNS IFNS IFNS IFNS IFNS IFNS IFN. цепей IFNAR1 и IFNAR2. Интерфероны типа I, присутствующие у людей, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
цепей IFNAR1 и IFNAR2. Интерфероны типа I, присутствующие у людей, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Рисунок 1. Трехмерная структура бета-интерферона человека.
| IFN-α | Белки IFN-α продуцируются лейкоцитами. Они в основном участвуют во врожденном иммунном ответе против вирусной инфекции. Гены, ответственные за их синтез, представлены 13 подтипами, которые называются IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21. Эти гены находятся вместе в кластере на хромосоме 9.. IFN-α также производится синтетически в качестве лекарства от волосатоклеточного лейкоза. Международное непатентованное наименование (МНН) продукта — интерферон альфа. Рекомбинантный тип представляет собой интерферон альфакон-1. Пегилированные типы представляют собой пегилированный интерферон альфа-2а и пегилированный интерферон альфа-2b. |
| IFN-β | Белки IFN-β продуцируются в больших количествах фибробластами. Они обладают противовирусной активностью, которая участвует в основном во врожденном иммунном ответе. Описаны два типа IFN-β: IFN-β1 (IFNB1) и IFN-β3 (IFNB3) (ген, обозначенный IFN-β2, на самом деле является IL-6). IFN-β1 используется для лечения рассеянного склероза, поскольку он снижает частоту рецидивов. IFN-β1 не подходит для лечения пациентов с прогрессирующими нерецидивирующими формами рассеянного склероза. Они обладают противовирусной активностью, которая участвует в основном во врожденном иммунном ответе. Описаны два типа IFN-β: IFN-β1 (IFNB1) и IFN-β3 (IFNB3) (ген, обозначенный IFN-β2, на самом деле является IL-6). IFN-β1 используется для лечения рассеянного склероза, поскольку он снижает частоту рецидивов. IFN-β1 не подходит для лечения пациентов с прогрессирующими нерецидивирующими формами рассеянного склероза. |
| IFN-κ | Интерферон каппа, также известный как IFN-каппа, представляет собой белок, который у человека кодируется геном IFNK. IFN-каппа является членом семейства интерферонов I типа. Интерфероны типа I представляют собой группу родственных гликопротеинов, играющих важную роль в защите хозяина от вирусных инфекций. Этот белок экспрессируется в кератиноцитах, а ген находится на хромосоме 9, рядом с кластером интерферона I типа. |
| IFN-ω | IFN-ω, хотя и имеет только одну описанную на сегодняшний день функциональную форму (IFNW1), имеет несколько псевдогенов: IFNWP2, IFNWP4, IFNWP5, IFNWP9, IFNWP15, IFNWP18 и IFNWP19 у людей.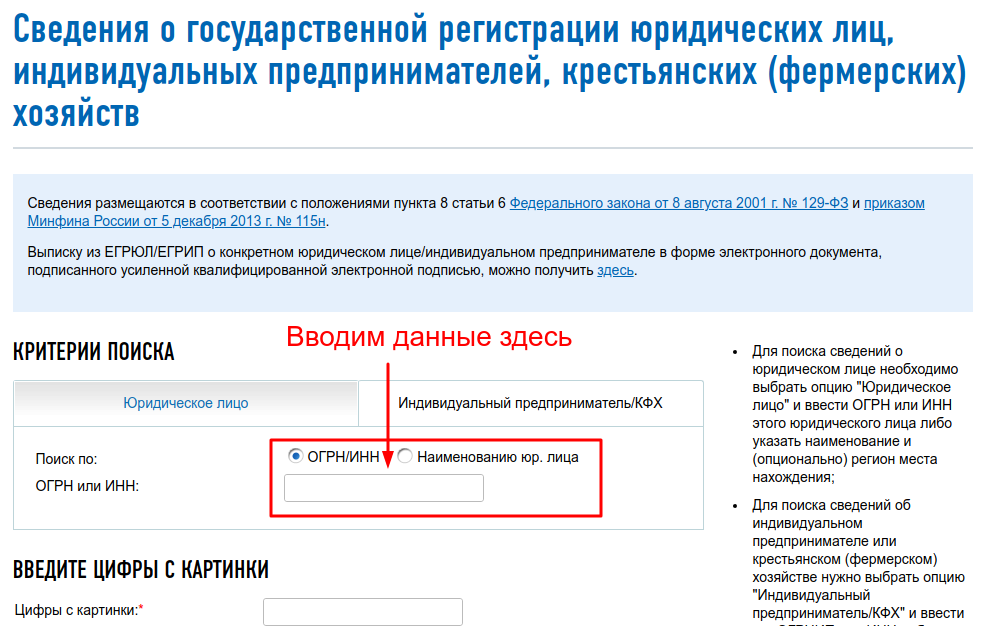 Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. |
Интерферон типа II
Единственный член составляет интерфероны типа II (ИФН), который называется ИФН-γ (гамма). Зрелый IFN-γ представляет собой антипараллельный гомодимер, который связывается с комплексом рецептора IFN-γ (IFNGR) для получения сигнала в клетке-мишени. IFNGR состоит из двух субъединиц, и каждая из молекул обозначает IFNGR1 и IFNGR2.
IFN-γ участвует в регуляции иммунных и воспалительных реакций; у человека существует только один тип интерферона-гамма. Он вырабатывается активированными Т-клетками и естественными клетками-киллерами. IFN-γ обладает некоторыми противовирусными и противоопухолевыми эффектами, но обычно они слабые. Однако этот цитокин потенцирует эффекты интерферонов I типа. IFN-γ, высвобождаемый клетками Th2, привлекает лейкоциты к очагу инфекции, что приводит к усилению воспаления. Он также стимулирует макрофаги к уничтожению бактерий, которые были поглощены. IFN-γ, высвобождаемый клетками Th2, также важен для регуляции ответа Th3. Поскольку IFN-γ жизненно важен для регуляции иммунного ответа, его продукция может приводить к аутоиммунным заболеваниям.
Он также стимулирует макрофаги к уничтожению бактерий, которые были поглощены. IFN-γ, высвобождаемый клетками Th2, также важен для регуляции ответа Th3. Поскольку IFN-γ жизненно важен для регуляции иммунного ответа, его продукция может приводить к аутоиммунным заболеваниям.
Рисунок 2. Трехмерная структура гамма-интерферона человека.
Интерферон типа III
Недавно классифицированная группа интерферонов типа III состоит из трех молекул IFN-λ (лямбда), называемых IFN-λ1, IFN-λ2 и IFN-λ3 (также называемых IL29, IL28B и IL28BA и соответственно). Эти сигналы IFN через рецепторный комплекс состоят из IL10R2 (также называемого CRF2-4) и IL28RA (также называемого IFNLR1, CRF2-12). Недавно вокруг того же геномного локуса был обнаружен новый белок с аналогичной функцией, родственный IFN-λ3, который был обозначен как IFN-λ4. Его внутриклеточная передача сигналов осуществлялась через IFNLR1 и, следовательно, считалась интерфероном типа III.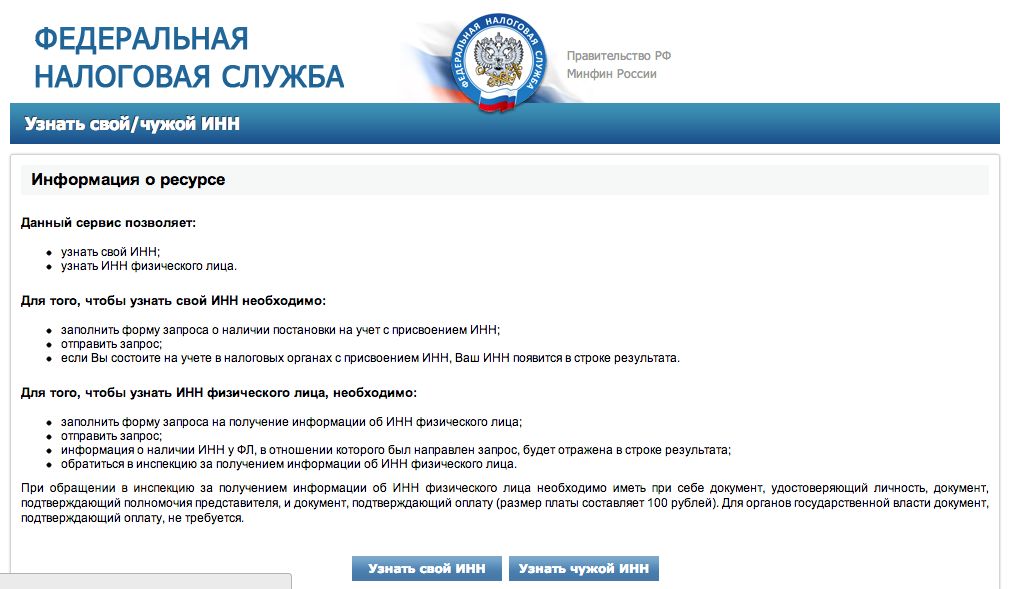 Однако доказательства его 9Биоактивность 0185 in vivo все еще остается спорной.
Однако доказательства его 9Биоактивность 0185 in vivo все еще остается спорной.
| IL29 | Интерлейкин-29 (IL-29) представляет собой белок, который у человека кодируется геном IL29, расположенным на хромосоме 19. Он является членом семейства спиральных цитокинов и интерфероном III типа. . Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген сильно активируется в клетках, инфицированных вирусами. Ил29отсутствует в геноме мыши. |
| IL28 | Интерлейкин-28 (IL-28) представляет собой цитокин, представленный двумя изоформами, IL-28A и IL-28B, и играет роль в иммунной защите от вирусов, включая индукцию «противовирусного состояния». » путем включения белков Mx, 2′,5′-олигоаденилатсинтетазы, а также ISGF3G (стимулируемый интерфероном генный фактор 3). IL-28A и IL-28B принадлежат к семейству цитокинов интерферона III типа и очень похожи (по аминокислотной последовательности) на IL-29. . Их классификация как интерферонов обусловлена их способностью индуцировать противовирусное состояние, в то время как их дополнительная классификация как цитокинов обусловлена их хромосомным расположением, а также тем фактом, что они кодируются несколькими экзонами, а не одним экзоном, как большинство типов. -I ИФН есть. . Их классификация как интерферонов обусловлена их способностью индуцировать противовирусное состояние, в то время как их дополнительная классификация как цитокинов обусловлена их хромосомным расположением, а также тем фактом, что они кодируются несколькими экзонами, а не одним экзоном, как большинство типов. -I ИФН есть. |
Клеточные функции
Все интерфероны имеют несколько общих эффектов: они являются противовирусными агентами и модулируют функции иммунной системы. Экспериментально было показано, что введение IFN типа I ингибирует рост опухоли у животных, но положительное действие на опухоли человека не было широко задокументировано. Зараженная вирусом клетка высвобождает вирусные частицы, которые могут инфицировать близлежащие клетки. Однако инфицированная клетка может подготовить соседние клетки к потенциальному заражению вирусом, высвобождая интерфероны. В ответ на интерферон клетки вырабатывают большое количество фермента, известного как протеинкиназа R (PKR). Этот фермент фосфорилирует белок, известный как eIF-2, в ответ на новые вирусные инфекции; фосфорилированный eIF-2 образует неактивный комплекс с другим белком, называемым eIF2B, для снижения синтеза белка внутри клетки. Другой клеточный фермент, РНКаза L, также индуцируемая действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов-хозяев. Ингибированный синтез белка уничтожает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием интерферон-стимулируемых генов (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет повышения активности p53, который убивает инфицированные вирусом клетки, способствуя апоптозу. Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Этот фермент фосфорилирует белок, известный как eIF-2, в ответ на новые вирусные инфекции; фосфорилированный eIF-2 образует неактивный комплекс с другим белком, называемым eIF2B, для снижения синтеза белка внутри клетки. Другой клеточный фермент, РНКаза L, также индуцируемая действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов-хозяев. Ингибированный синтез белка уничтожает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием интерферон-стимулируемых генов (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет повышения активности p53, который убивает инфицированные вирусом клетки, способствуя апоптозу. Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой функцией интерферонов является активация молекул главного комплекса гистосовместимости, MHC I и MHC II, и повышение активности иммунопротеасом. Более высокая экспрессия MHC I увеличивает презентацию вирусных пептидов цитотоксическим Т-клеткам, в то время как иммунопротеасома обрабатывает вирусные пептиды для загрузки на молекулу MHC I, тем самым увеличивая распознавание и уничтожение инфицированных клеток. Более высокая экспрессия MHC II увеличивает презентацию вирусных пептидов хелперным Т-клеткам; эти клетки выделяют цитокины (например, больше интерферонов и интерлейкинов), которые сигнализируют и координируют активность других иммунных клеток. Интерфероны, такие как гамма-интерферон, непосредственно активируют другие иммунные клетки, макрофаги и естественные клетки-киллеры.
Более высокая экспрессия MHC I увеличивает презентацию вирусных пептидов цитотоксическим Т-клеткам, в то время как иммунопротеасома обрабатывает вирусные пептиды для загрузки на молекулу MHC I, тем самым увеличивая распознавание и уничтожение инфицированных клеток. Более высокая экспрессия MHC II увеличивает презентацию вирусных пептидов хелперным Т-клеткам; эти клетки выделяют цитокины (например, больше интерферонов и интерлейкинов), которые сигнализируют и координируют активность других иммунных клеток. Интерфероны, такие как гамма-интерферон, непосредственно активируют другие иммунные клетки, макрофаги и естественные клетки-киллеры.
Рисунок 3. Штриховое и мультипликационное изображение димера IFNγ.
Роль в заболевании
Интерферон бета-1а и интерферон бета-1b используются для лечения и контроля рассеянного склероза, аутоиммунного заболевания. Это лечение эффективно для уменьшения приступов при рецидивирующем-ремиттирующем рассеянном склерозе и замедления прогрессирования заболевания и активности при вторично-прогрессирующем рассеянном склерозе.
Терапия интерфероном используется (в сочетании с химиотерапией и облучением) для лечения некоторых видов рака. Это лечение может быть использовано при гемобластозах; лейкемия и лимфомы, включая волосатоклеточный лейкоз, хронический миелоидный лейкоз, узловую лимфому и кожную Т-клеточную лимфому. Пациенты с рецидивирующими меланомами получают рекомбинантный IFN-α2b. Как гепатит В, так и гепатит С лечат IFN-α, часто в сочетании с другими противовирусными препаратами. Некоторые из тех, кто лечился интерфероном, имеют устойчивый вирусологический ответ и могут элиминировать вирус гепатита. Наиболее опасный штамм — вирус гепатита С генотипа I — можно лечить с вероятностью успеха 60-80% с помощью текущего стандартного лечения интерфероном-α, рибавирином и недавно одобренными ингибиторами протеазы, такими как телапревир (Incivek) май 2011 г. , Боцепревир (Виктрелис), май 2011 г., или аналог нуклеотидного ингибитора полимеразы Софосбувир (Совальди), декабрь 2013 г. Биопсии пациентов, получавших лечение, показывают уменьшение повреждения печени и цирроза.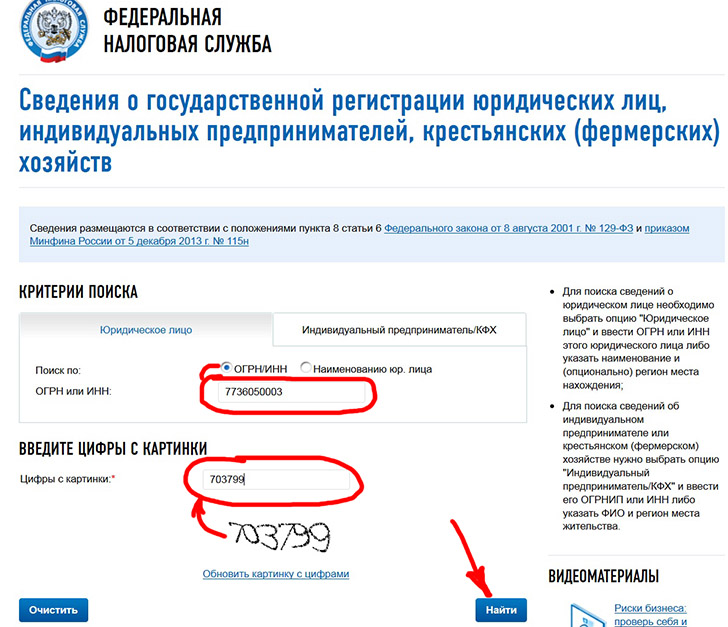 Некоторые данные показывают, что введение интерферона сразу после заражения может предотвратить хронический гепатит С, хотя диагностика на ранних стадиях инфекции затруднена, поскольку физические симптомы при ранней инфекции гепатита С редки. Контроль хронического гепатита С с помощью IFN связан с уменьшением гепатоцеллюлярной карциномы.
Некоторые данные показывают, что введение интерферона сразу после заражения может предотвратить хронический гепатит С, хотя диагностика на ранних стадиях инфекции затруднена, поскольку физические симптомы при ранней инфекции гепатита С редки. Контроль хронического гепатита С с помощью IFN связан с уменьшением гепатоцеллюлярной карциномы.
Имеются доказательства низкого качества, свидетельствующие о том, что глазные капли с интерфероном могут быть эффективным средством для лечения пациентов с эпителиальным кератитом, вызванным вирусом простого герпеса, типом глазной инфекции. Нет четких доказательств того, что удаление инфицированной ткани (санация) с последующим применением капель интерферона является эффективным подходом к лечению этих типов глазных инфекций. Доказательства низкого качества свидетельствуют о том, что комбинация интерферона и противовирусного препарата может ускорить процесс заживления по сравнению с одной только противовирусной терапией.
Ссылки:
- Де Андреа М.
 , Равера Р., Джоя Д., Гарильо М., Ландольфо С. (2002). «Система интерферона: обзор». Европейский журнал детской неврологии . 6 Приложение А (6): A41–6; обсуждение A55–8.
, Равера Р., Джоя Д., Гарильо М., Ландольфо С. (2002). «Система интерферона: обзор». Европейский журнал детской неврологии . 6 Приложение А (6): A41–6; обсуждение A55–8. - Леви Д.Е., Мари И.Дж., Дурбин Д.Е. (декабрь 2011 г.). «Индукция и функция интерферона типа I и III в ответ на вирусную инфекцию». Текущее мнение в области вирусологии. 1 (6): 476–86.
- Хермант П., Михилс Т. (2014). «Интерферон-λ в контексте вирусных инфекций: производство, реакция и терапевтические последствия». Журнал врожденного иммунитета . 6 (5): 563–74.
- Навратил В., де Шасси Б., Мейниэль Л., Прадезински Ф., Андре П., Рабурден-Комб С., Лотто В. (июль 2010 г.). «Сравнение белок-белковых взаимодействий между вирусами и сетью системы интерферона I типа человека на системном уровне». Журнал исследований протеома. 9 (7): 3527–36.
- Шариев К.А., Дункан Д., Юносси З. (февраль 2002 г.). «Достижения в лечении хронического гепатита С:« пегилированные »интерфероны».
 Медицинский журнал Кливлендской клиники. 69 (2): 155–9.
Медицинский журнал Кливлендской клиники. 69 (2): 155–9. - Тан Ю.Х., Тишфилд Дж., Раддл Ф.Х. (февраль 1973 г.). «Связь генов человеческого противовирусного белка, индуцированного интерфероном, и признаков индофенолоксидазы-B с хромосомой G-21». Журнал экспериментальной медицины. 137 (2): 317–30.
Вернуться к ресурсам
Регуляция реакции интерферона I типа
1. Trinchieri G. Интерферон I типа: друг или враг? Дж. Эксп. Мед. 2010;207:2053–2063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Пестка С., Краузе К.Д., Вальтер М.Р. Интерфероны, интерфероноподобные цитокины и их рецепторы. Иммунол. 2004; 202:8–32. [PubMed] [Google Scholar]
3. Hertzog PJ, Williams BR. Точная настройка реакции интерферона I типа. Cytokine Growth Factor Rev. 2013; 24:217–225. [PubMed] [Google Scholar]
4. Палудан С.Р., Боуи А.Г. Иммунное распознавание ДНК. Иммунитет. 2013; 38: 870–880. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Goubau D, Deddouche S, Reis ESC. Цитозольное зондирование вирусов. Иммунитет. 2013; 38: 855–869.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Goubau D, Deddouche S, Reis ESC. Цитозольное зондирование вирусов. Иммунитет. 2013; 38: 855–869.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Ивасаки А. Вирусологический взгляд на распознавание врожденного иммунитета. Анну. Преподобный Микробиолог. 2012;66:177–196. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Леви Д.Э., Дарнелл Дж.Э., мл. STATs: транскрипционный контроль и биологическое воздействие. Природа Преподобный Мол. Клеточная биол. 2002; 3: 651–662. [PubMed] [Google Scholar]
8. Старк Г. Р., Дарнелл Дж. Э. Младший Путь JAK-STAT в двадцать лет. Иммунитет. 2012; 36: 503–514. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. МакМикинг Д.Д. Эффекторные механизмы, индуцируемые интерфероном, в клеточно-автономном иммунитете. Природа Преподобный Иммунол. 2012;12:367–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10.
Шоггинс Дж. В. и соавт. Разнообразные генные продукты являются эффекторами противовирусного ответа интерферона I типа. Природа. 2011; 472:481–485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Природа. 2011; 472:481–485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование идентифицирует определенные антивирусные функции для нескольких ISG, показывая, что уникальные наборы ISG нацелены на разные вирусы. Это подчеркивает важность трансляционной регуляции.
11. Русинова И. и соавт. Interferome v2.0: обновленная база данных аннотированных генов, регулируемых интерфероном. Нуклеиновые Кислоты Res. 2012;41:D1040–D1046. [Статья бесплатно PMC] [PubMed] [Google Scholar]
12. Сака Х.А., Вальдивия Р. Новые роли липидных капель в иммунитете и взаимодействиях хозяин-патоген. Анну. Преподобный Cell Dev. биол. 2012; 28:411–437. [PubMed] [Google Scholar]
13. Ван Боксель-Дезер А.Х., Рани М.Р., Старк Г.Р. Комплексная модуляция передачи сигналов, специфичных для типа клеток, в ответ на интерфероны типа I. Иммунитет. 2006; 25: 361–372. [PubMed] [Академия Google]
14. Гоф Д.Дж., Мессина Н.Л., Кларк С.Дж., Джонстон Р.В., Леви Д.Е. Конститутивный интерферон типа I модулирует гомеостатический баланс посредством тонической передачи сигналов. Иммунитет. 2012; 36: 166–174. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иммунитет. 2012; 36: 166–174. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15.
Абт М.С. и др. Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета. Иммунитет. 2012; 37: 158–170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вместе со ссылками 16 и 17 это исследование демонстрирует, что комменсальная микрофлора калибрует врожденные иммунные ответы и частично поддерживает гомеостаз, обеспечивая тонические сигналы, которые поддерживают базальный системный ответ IFN.
16. Ганал С.К. и др. Примирование естественных клеток-киллеров неслизистыми мононуклеарными фагоцитами требует инструктивных сигналов от комменсальной микробиоты. Иммунитет. 2012; 37: 171–186. [PubMed] [Google Scholar]
17. Kawashima T, et al. Двухцепочечная РНК кишечных комменсальных, но не патогенных бактерий запускает выработку защитного интерферона-β Иммунитет. 2013;38:1187–1197. [PubMed] [Google Scholar]
18.
Ван Л. и др. «Настройка» индуцированной интерфероном I типа передачи сигналов Jak-STAT1 с помощью кальций-зависимых киназ в макрофагах. Натура Иммунол. 2008;9: 186–193. [PubMed] [Академия Google]
«Настройка» индуцированной интерфероном I типа передачи сигналов Jak-STAT1 с помощью кальций-зависимых киназ в макрофагах. Натура Иммунол. 2008;9: 186–193. [PubMed] [Академия Google]
Это исследование демонстрирует перекрестную регуляцию передачи сигналов IFN I типа с помощью ITAM-ассоциированных рецепторов с последующей тонкой настройкой индукции ISG.
19. Gilchrist DA, et al. Регулирование регуляторов: всеобъемлющие эффекты паузы Pol II на чувствительных к стимулам генных сетях. Гены Дев. 2012; 26: 933–944. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Papadopoulou AS, et al. Эпителиальная сеть микроРНК тимуса повышает порог инволюции тимуса, связанной с инфекцией, посредством миР-29.опосредованное подавление рецептора IFN-α. Натура Иммунол. 2012;13:181–187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Lu LF, et al. Функция миР-146a в контроле опосредованной клетками Treg регуляции ответов Th2. Клетка. 2010; 142:914–929. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22.
Грасиас Д.Т. и соавт. МикроРНК миР-155 контролирует ответы CD8 + Т-клеток, регулируя передачу сигналов интерферона. Натура Иммунол. 2013; 14: 593–602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование устанавливает, что miRNAs регулируют ответы IFN типа I, демонстрируя, что miR-155 нацеливается на компоненты передачи сигналов IFN.
23. Дэвид М. Интерфероны и микроРНК. J. Интерферон Цитокин Res. 2010;30:825–828. [PubMed] [Google Scholar]
24.
Леви Д.Е., Лью Д.Дж., Декер Т., Кесслер Д.С., Дарнелл Дж.Е., мл. Синергическое взаимодействие между интерфероном-α и интерфероном-γ посредством индуцированного синтеза одной субъединицы фактора транскрипции ISGF3. EMBO J. 1990; 9: 1105–1111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вместе со ссылкой 25 это исследование демонстрирует, что примирование усиленных ответов IFN опосредовано повышенной экспрессией IRF9.и СТАТ1.
25. Hu X, et al. Сенсибилизация передачи сигналов IFN-γ Jak-STAT во время активации макрофагов. Натура Иммунол. 2002; 3: 859–866. [PubMed] [Google Scholar]
Натура Иммунол. 2002; 3: 859–866. [PubMed] [Google Scholar]
26. Tassiulas I, et al. Усиление IFN-α-индуцированной активации STAT1 и воспалительной функции с помощью адаптеров, содержащих Syk и ITAM. Натура Иммунол. 2004; 5:1181–1189. [PubMed] [Google Scholar]
27. Hu X, Park-Min KH, Ho HH, Ивашкив ЛБ. IFN-γ-примированные макрофаги демонстрируют повышенную CCR2-зависимую миграцию и измененные ответы IFN-γ, опосредованные Stat1. Дж. Иммунол. 2005; 175:3637–3647. [PubMed] [Академия Google]
28. Ярилина А, Пак-Мин К-Х, Антонив Т, Ху Х, Ивашкив ЛБ. TNF активирует IRF1-зависимую аутокринную петлю, что приводит к устойчивой экспрессии хемокинов и STAT1-зависимых генов ответа на интерферон I типа. Натура Иммунол. 2008; 9: 378–387. [PubMed] [Google Scholar]
29. Venkatesh D, et al. Эндотелиальный рецептор TNF 2 индуцирует зависимую от фактора транскрипции IRF1 аутокринную передачу сигналов интерферона-бета, что способствует рекрутированию моноцитов. Иммунитет. 2013;38:1025–1037. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Cheon H, et al. Зависимое от IFNβ увеличение STAT1, STAT2 и IRF9 опосредует устойчивость к вирусам и повреждениям ДНК. EMBO J. 2013; 32: 2751–2763. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Fuchs SY. Надежда и страх перед интерфероном: рецептор-ориентированный взгляд на будущее терапии интерфероном. J. Интерферон Цитокин Res. 2013;33:211–225. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. де Верд Н.А., Нгуен Т. Интерфероны и их рецепторы — распределение и регулирование. Иммунол. Клеточная биол. 2012;90: 483–491. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Bhattacharya S, et al. Противоопухолевые эффекты интерферона типа 1 подавляются комплексными реакциями на стресс. Онкоген. 2013;32:4214–4221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Huynh L, Wang L, Shi C, Park-Min KH, Ivashkiv LB. Рецепторы, связанные с ITAM, ингибируют передачу сигналов IFNAR и изменяют ответы макрофагов на TLR4 и Listeria monocytogenes .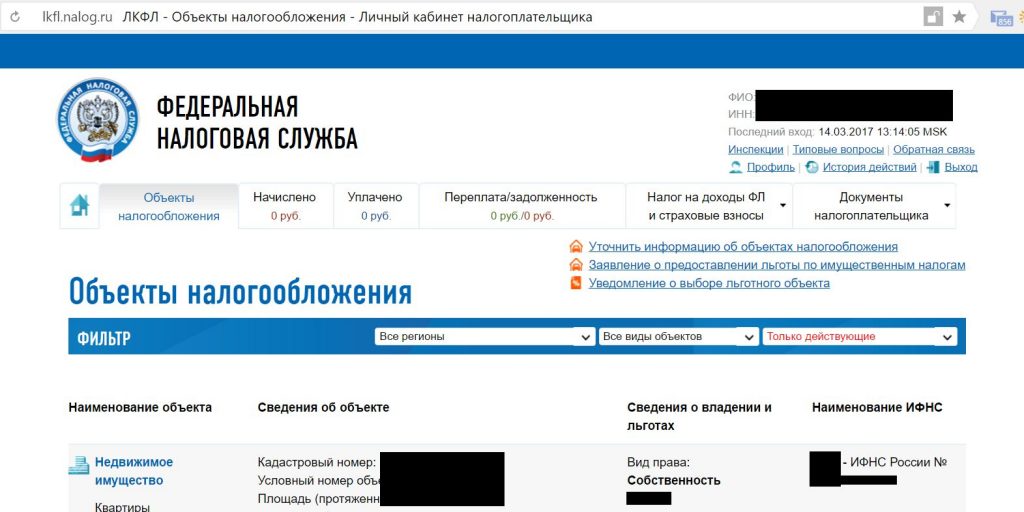 Дж. Иммунол. 2012; 188:3447–3457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Иммунол. 2012; 188:3447–3457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Huangfu W-C, et al. Воспалительная передача сигналов нарушает клеточный ответ на альфа-интерферон. Онкоген. 2011;31:161–172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Liu J, et al. Вирус-индуцированный ответ развернутого белка ослабляет противовирусную защиту посредством фосфорилирования-зависимой деградации рецептора интерферона I типа. Клеточный микроб-хозяин. 2009; 5:72–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Wang L, et al. Косвенное ингибирование ответов Toll-подобных рецепторов и интерферона I типа с помощью ITAM-связанных рецепторов и интегринов. Иммунитет. 2010; 32: 518–530. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Du Z, et al. Ингибирование передачи сигналов IFN-α зависимым от PKC и протеинтирозинфосфатазы SHP-2. проц. Натл акад. науч. США. 2005; 102:10267–10272. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Йошимура А., Нака Т., Кубо М. Белки SOCS, передача сигналов цитокинов и иммунная регуляция. Природа Преподобный Иммунол. 2007; 7: 454–465. [PubMed] [Google Scholar]
Йошимура А., Нака Т., Кубо М. Белки SOCS, передача сигналов цитокинов и иммунная регуляция. Природа Преподобный Иммунол. 2007; 7: 454–465. [PubMed] [Google Scholar]
40. Sarasin-Filipowicz M, et al. Альфа-интерферон индуцирует длительную рефрактерность передачи сигналов JAK-STAT в печени мышей посредством индукции USP18/UBP43. Мол. Клетка. биол. 2009 г.;29:4841–4851. [бесплатная статья PMC] [PubMed] [Google Scholar]
41. Назаров П.В., и соавт. Взаимодействие микроРНК, факторов транскрипции и генов-мишеней: связывание динамических изменений экспрессии с функцией. Нуклеиновые Кислоты Res. 2013;41:2817–2831. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Tili E, et al. Модуляция уровней миР-155 и миР-125b после стимуляции липополисахаридом/ФНО-α и их возможная роль в регуляции ответа на эндотоксиновый шок. Дж. Иммунол. 2007;179: 5082–5089. [PubMed] [Google Scholar]
43. Мюррей П.Дж. Сигнальный путь JAK-STAT: интеграция входа и выхода. Дж. Иммунол. 2007; 178: 2623–2629.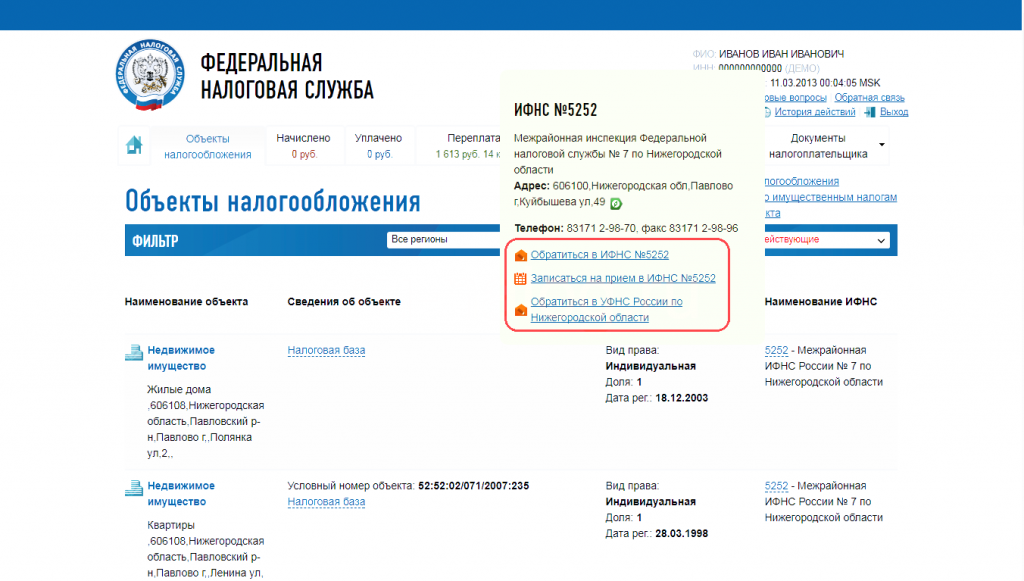 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
44. Хо Х.Х., Ивашкив Л.Б. Роль STAT3 в реакциях интерферона I типа. Отрицательная регуляция STAT1-зависимой активации воспалительного гена. Дж. Биол. хим. 2006; 281:14111–14118. [PubMed] [Google Scholar]
45. Wang WB, Levy DE, Lee CK. STAT3 негативно регулирует IFN-опосредованный противовирусный ответ I типа. Дж. Иммунол. 2011;187:2578–2585. [PubMed] [Академия Google]
46.
Нгуен К.Б. и др. Критическая роль активации STAT4 интерферонами типа 1 в ответе гамма-интерферона на вирусную инфекцию. Наука. 2002; 297:2063–2066. [PubMed] [Академия Google]
Это исследование демонстрирует переключение передачи сигналов IFN типа I со STAT1 на STAT4, которое формирует ответы CD8 + Т-клеток во время вирусной инфекции in vivo .
47. Gil MP, et al. Регулирование эффектов IFN 1 типа в CD8 T-клетках во время вирусных инфекций: изменение экспрессии STAT4 и STAT1 для функции. Кровь. 2012;120:3718–3728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Tenoever BR, et al. Множественные функции IKK-родственной киназы IKKε в интерферон-опосредованном противовирусном иммунитете. Наука. 2007; 315:1274–1278. [PubMed] [Google Scholar]
Tenoever BR, et al. Множественные функции IKK-родственной киназы IKKε в интерферон-опосредованном противовирусном иммунитете. Наука. 2007; 315:1274–1278. [PubMed] [Google Scholar]
49. Ng SL, et al. IkappaB kinase epsilon (IKKε) регулирует баланс между интерфероновыми ответами типа I и типа II. проц. Натл акад. науч. США. 2012;108:21170–21175. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Robinson N, et al. Интерферон типа I индуцирует некроптоз макрофагов при заражении Salmonella enterica серовар Typhimurium. Натура Иммунол. 2012;13:954–962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. de Weerd NA, et al. Структурная основа уникальной сигнальной оси интерферона-β, опосредованной через рецептор IFNAR1. Натура Иммунол. 2013; 14:901–907. [PubMed] [Google Scholar]
52. Sadzak I, et al. Рекрутирование Stat1 на хроматин необходимо для индуцированного интерфероном серинового фосфорилирования домена трансактивации Stat1. проц. Натл акад.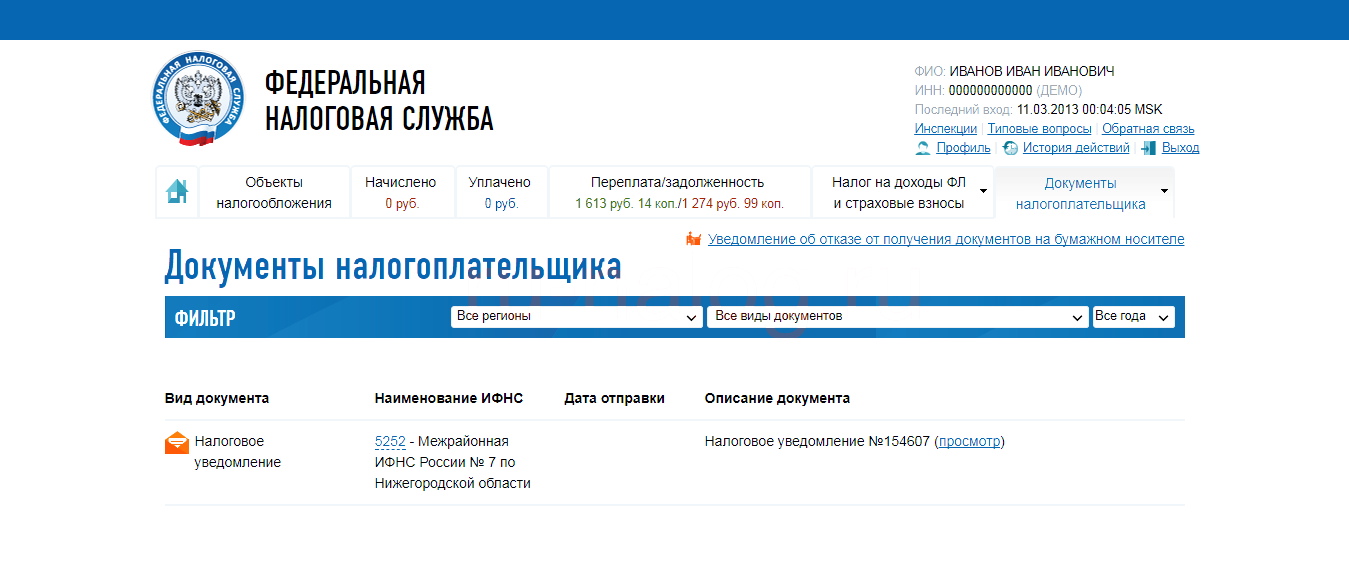 науч. США. 2008;105:8944–8949. [Бесплатная статья PMC] [PubMed] [Google Scholar]
науч. США. 2008;105:8944–8949. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Bancerek J, et al. Киназа CDK8 фосфорилирует фактор транскрипции STAT1, чтобы избирательно регулировать ответ интерферона. Иммунитет. 2013; 38: 250–262. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Yang J, et al. Обратимое метилирование связанного с промотором STAT3 ферментами, модифицирующими гистоны. проц. Натл акад. науч. США. 2010;107:21499–21504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Droescher M, Begitt A, Marg A, Zacharias M, Vinkemeier U. Паракристаллы, индуцированные цитокинами, продлевают активность преобразователей сигналов и активаторов транскрипции (STAT) и обеспечивают модель регуляции растворимости белка малым убиквитин-подобным модификатором (SUMO) J. Biol. хим. 2011; 286:18731–18746. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Ху X, Ивашкив Л.Б. Перекрестная регуляция сигнальных путей интерфероном-γ: значение для иммунных реакций и аутоиммунных заболеваний.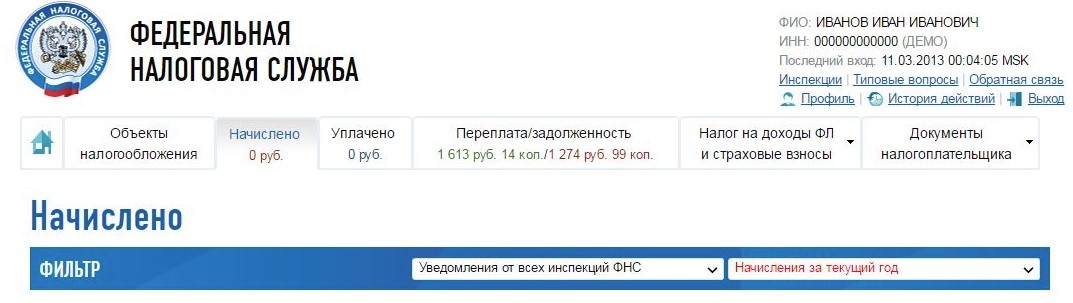 Иммунитет. 2009; 31: 539–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иммунитет. 2009; 31: 539–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Tamura T, Yanai H, Savitsky D, Taniguchi T. Транскрипционные факторы семейства IRF в иммунитете и онкогенезе. Анну. Преподобный Иммунол. 2008; 26: 535–584. [PubMed] [Google Scholar]
58. Леви Д.Э., Мари И., Смит Э., Пракаш А. Усиление и диверсификация индукции IFN с помощью положительной обратной связи, опосредованной IRF-7. J. Интерферон Цитокин Res. 2002; 22: 87–9.3. [PubMed] [Google Scholar]
59. Farlik M, et al. Вклад TANK-связывающей киназы 1-интерферона (IFN) регуляторного фактора 7 пути в экспрессию генов, индуцированную IFN-γ. Мол. Клетка. биол. 2012;32:1032–1043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60.
Цяо Ю и др. Синергетическая активация генов воспалительных цитокинов за счет ремоделирования хроматина, индуцированного интерфероном-γ, и передачи сигналов Toll-подобных рецепторов. Иммунитет. 2013; 39: 454–469. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вместе со ссылками 79 и 80 , это исследование демонстрирует повсеместное связывание STAT1 с промоторами и энхансерами по всему геному, что программирует клеточные ответы на сигналы окружающей среды.
61. Чаттерджи-Кишор М., Райт К.Л., Тинг Дж.П., Старк Г.Р. Как Stat1 обеспечивает экспрессию конститутивного гена: комплекс нефосфорилированного Stat1 и IRF1 поддерживает транскрипцию гена LMP2. EMBO J. 2000;19:4111–4122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Farlik M, et al. Нетрадиционная сборка комплекса инициации факторами транскрипции STAT и NF-κB регулирует экспрессию синтазы оксида азота. Иммунитет. 2010;33:25–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Xu D, et al. Белок цинкового пальца промиелоцитарного лейкоза регулирует интерферон-опосредованный врожденный иммунитет. Иммунитет. 2009; 30:802–816. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Litvak V, et al. Регуляторная цепь гена FOXO3-IRF7 ограничивает воспалительные последствия противовирусных реакций. Природа. 2012; 490:421–425. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Shalek AK, et al. Транскриптомика одиночных клеток выявляет бимодальность экспрессии и сплайсинга в иммунных клетках. Природа. 2013;498: 236–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Природа. 2013;498: 236–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Zhao M, Zhang J, Phatnani H, Scheu S, Maniatis T. Стохастическая экспрессия гена интерферона-бета. PLoS биол. 2012;10:e1001249. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Hwang SY, et al. Двухфазный ответ RLR-IFN-β контролирует баланс между противовирусным иммунитетом и повреждением клеток. Дж. Иммунол. 2013;190:1192–1200. [PubMed] [Google Scholar]
68. Белл О., Тивари В.К., Тома Н.Х., Шубелер Д. Детерминанты и динамика доступности генома. Природа Преподобный Жене. 2011; 12: 554–564. [PubMed] [Академия Google]
69. Смейл СТ. Избирательная транскрипция в ответ на воспалительный стимул. Клетка. 2010; 140:833–844. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Yan Z, et al. Для комплекса ремоделирования хроматина PBAF требуется новая субъединица специфичности, BAF200, для регуляции экспрессии селективных генов, чувствительных к интерферону. Гены Дев.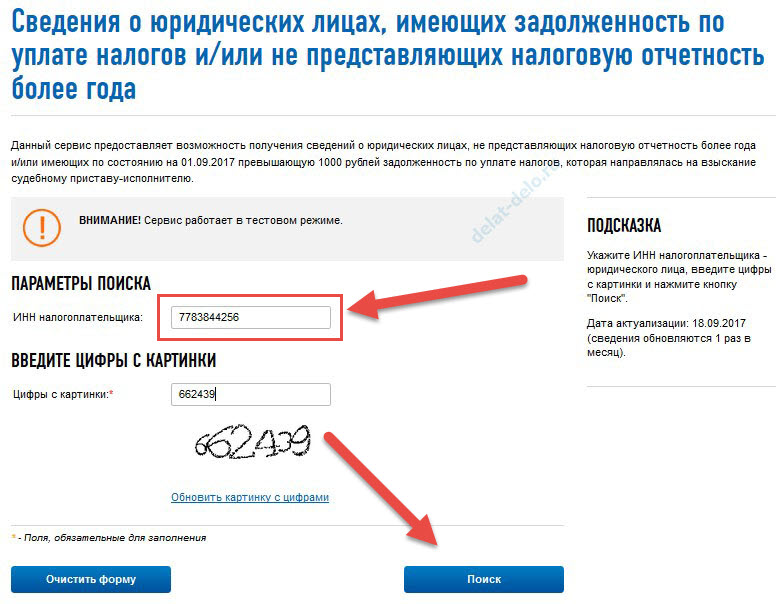 2005; 19: 1662–1667. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2005; 19: 1662–1667. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Liu H, Kang H, Liu R, Chen X, Zhao K. Максимальная индукция подмножества генов-мишеней интерферона требует ремоделирующей хроматин активности комплекса BAF. . Мол. Клетка. биол. 2002; 22:6471–6479.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Cui K, et al. Комплекс BAF, ремоделирующий хроматин, опосредует клеточную противовирусную активность за счет праймирования промотора. Мол. Клетка. биол. 2004; 24:4476–4486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Huang M, et al. Фактор ремоделирования хроматина BRG1 избирательно активирует подмножество генов, индуцируемых интерфероном-α. Природа Клетка Биол. 2002; 4: 774–781. [PubMed] [Google Scholar]
74. Ni Z, et al. Апикальная роль BRG1 в индуцированной цитокинами сборке промотора. проц. Натл акад. науч. США. 2005; 102:14611–14616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75.
Рамирес-Карроцци В. Р. и др. Избирательные и антагонистические функции комплексов ремоделирования нуклеосом SWI/SNF и Mi-2β во время воспалительной реакции. Гены Дев. 2006; 20: 282–296. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Р. и др. Избирательные и антагонистические функции комплексов ремоделирования нуклеосом SWI/SNF и Mi-2β во время воспалительной реакции. Гены Дев. 2006; 20: 282–296. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование устанавливает важность ремоделирования хроматина для индукции воспалительных генов и ISG.
76. Ramirez-Carrozzi VR, et al. Объединяющая модель селективной регуляции индуцируемой транскрипции островками CpG и ремоделирования нуклеосом. Клетка. 2009 г.;138:114–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Bhatt DM, et al. Динамика транскриптов провоспалительных генов, выявленная с помощью анализа последовательности субклеточных фракций РНК. Клетка. 2012; 150: 279–290. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Zentner GE, Henikoff S. Регуляция динамики нуклеосом модификациями гистонов. Структура природы. Мол. биол. 2013;20:259–266. [PubMed] [Google Scholar]
79. Vahedi G, et al. STAT формируют ландшафт активных энхансеров популяций Т-клеток. Клетка. 2012;151:981–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка. 2012;151:981–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Ostuni R, et al. Скрытые энхансеры активируются при стимуляции в дифференцированных клетках. Клетка. 2013; 152:157–171. [PubMed] [Google Scholar]
81. Харгривз Д.К., Хорнг Т., Меджитов Р. Контроль экспрессии индуцибельных генов с помощью сигнал-зависимой элонгации транскрипции. Клетка. 2009; 138:129–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82.
Никодим Э. и др. Подавление воспаления синтетическим миметиком гистонов. Природа. 2010;468:1119–1123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование демонстрирует возможность терапевтического воздействия на регуляторные белки хроматина для селективного подавления воспалительного гена и экспрессии ISG.
83. Patel MC, et al. BRD4 координирует рекрутирование фактора высвобождения паузы P-TEFb и комплекса паузы NELF/DSIF для регуляции удлинения транскрипции генов, стимулируемых интерфероном. Мол. Клетка. биол. 2013;33:2497–2507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2013;33:2497–2507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Шекспир М.Р., Халили М.А., Ирвин К.М., Фэрли Д.П., Свит М.Дж. Деацетилазы гистонов как регуляторы воспаления и иммунитета. Тренды Иммунол. 2011;32:335–343. [PubMed] [Академия Google]
85. Fonseca GJ, et al. Уклонение аденовируса от интерферон-опосредованного врожденного иммунитета за счет прямого антагонизма посттрансляционной модификации клеточного гистона. Клеточный микроб-хозяин. 2012; 11: 597–606. [PubMed] [Google Scholar]
86. Lau JF, Nusinzon I, Burakov D, Freedman LP, Horvath CM. Роль белков-посредников многоклеточных животных в интерферон-чувствительной транскрипции. Мол. Клетка. биол. 2003; 23: 620–628. [PMC free article] [PubMed] [Google Scholar]
87. Гнатовский Л., Мита П., Леви Д.Е. Комплекс человеческого RVB необходим для эффективной транскрипции генов, стимулируемых IFN I типа. Мол Ячейка. биол. 2013; 33:3817–3825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Flammer JR, et al. Сигнальный путь интерферона I типа является мишенью для ингибирования глюкокортикоидами. Мол. Клетка. биол. 2010;30:4564–4574. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Flammer JR, et al. Сигнальный путь интерферона I типа является мишенью для ингибирования глюкокортикоидами. Мол. Клетка. биол. 2010;30:4564–4574. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89.
Икарди Л. и др. Репрессорный комплекс Sin3a является основным регулятором транскрипционной активности STAT. проц. Натл акад. науч. США. 2012;109:12058–12063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование раскрывает ассоциацию ко-репрессоров со специфическими STAT как механизм, который может избирательно подавлять экспрессию подмножеств генов ответа на IFN I типа.
90. Tahk S, et al. Контроль специфичности и величины активации генов, опосредованной NF-κB и STAT1, посредством сотрудничества PIASy и PIAS1. проц. Натл акад. науч. США. 2007; 104:11643–11648. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Шуай К., Лю Б. Регуляция путей активации генов белками PIAS в иммунной системе. Природа Преподобный Иммунол. 2005; 5: 593–605. [PubMed] [Google Scholar]
92. Liu B, Tahk S, Yee KM, Fan G, Shuai K. Лигаза PIAS1 ограничивает дифференцировку естественных регуляторных Т-клеток путем эпигенетической репрессии. Наука. 2010;330:521–525. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Liu B, Tahk S, Yee KM, Fan G, Shuai K. Лигаза PIAS1 ограничивает дифференцировку естественных регуляторных Т-клеток путем эпигенетической репрессии. Наука. 2010;330:521–525. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Marazzi I, et al. Подавление противовирусного ответа миметиком гистонов гриппа. Природа. 2012; 483:428–433. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Natoli G, Ghisletti S, Barozzi I. Геномные ландшафты воспаления. Гены Дев. 2011; 25:101–106. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Fang TC, et al. Диметилирование гистона h4 лизина 9 как эпигенетическая характеристика интерферонового ответа. Дж. Эксп. Мед. 2012; 209: 661–669. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Ea CK, Hao S, Yeo KS, Baltimore D. Белок EHMT1 связывается с ядерным фактором-κB p50 и подавляет экспрессию генов. Дж. Биол. хим. 2012; 287:31207–31217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Уолш Д., Мэтьюз М. Б., Мор И. Работа с переводом: синтез белка в инфицированных вирусом клетках. Харб Колд Спринг. Перспектива. биол. 2013;5:a012351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Б., Мор И. Работа с переводом: синтез белка в инфицированных вирусом клетках. Харб Колд Спринг. Перспектива. биол. 2013;5:a012351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Kaur S, et al. Регуляторные эффекты комплексов mTORC2 в передаче сигналов IFN I типа и в генерации ответов IFN. проц. Натл акад. науч. США. 2012;109: 7723–7728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Kaur S, et al. Роль пути Akt в трансляции мРНК генов, стимулируемых интерфероном. проц. Натл акад. науч. США. 2008; 105:4808–4813. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Джоши С., Каур С., Крочинска Б., Платаниас Л.С. Механизмы трансляции мРНК генов, стимулируемых интерфероном. Цитокин. 2010;52:123–127. [PubMed] [Google Scholar]
101. Rani MR, Hibbert L, Sizemore N, Stark GR, Ransohoff RM. Потребность в фосфоинозитид-3-киназы и Akt для интерферон-β-опосредованной индукции гена бета-R1 (SCYB11). Дж. Биол. хим. 2002; 277:38456–38461. [PubMed] [Академия Google]
102. Thoreen CC, et al. Объединяющая модель для mTORC1-опосредованной регуляции трансляции мРНК. Природа. 2012; 485:109–113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Thoreen CC, et al. Объединяющая модель для mTORC1-опосредованной регуляции трансляции мРНК. Природа. 2012; 485:109–113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Hsieh AC, et al. Трансляционный ландшафт передачи сигналов mTOR управляет инициацией и метастазированием рака. Природа. 2012; 485:55–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Colina R, et al. Трансляционный контроль врожденного иммунного ответа через IRF-7. Природа. 2008; 452:323–328. [PubMed] [Академия Google]
105. Ruggieri A, et al. Динамические колебания трансляции и образование стрессовых гранул отмечают клеточный ответ на вирусную инфекцию. Клеточный микроб-хозяин. 2012;12:71–85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Terenzi F, Hui DJ, Merrick WC, Sen GC. Различные модели индукции и функции двух близкородственных интерферон-индуцируемых генов человека, ISG54 и ISG56. Дж. Биол. хим. 2006; 281:34064–34071. [PubMed] [Google Scholar]
107. Fensterl V, Sen GC. Семейство генов ISG56/IFIT1. J. Интерферон Цитокин Res. 2011; 31:71–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Fensterl V, Sen GC. Семейство генов ISG56/IFIT1. J. Интерферон Цитокин Res. 2011; 31:71–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Ли М.С., Ким Б., О Г.Т., Ким Ю.Дж. OASL1 ингибирует трансляцию транскрипционного фактора IRF7, регулирующего интерферон I типа. Натура Иммунол. 2013;14:346–355. [PubMed] [Google Scholar]
109. Холл Дж. К., Розен А. Интерфероны типа I: важные участники амплификации заболевания при аутоиммунитете. Природа Преподобный Ревматол. 2010;6:40–49. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Maurano MT, et al. Систематическая локализация распространенных при заболеваниях вариаций в регуляторной ДНК. Наука. 2012;337:1190–1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Rai E, Wakeland EK. Генетическая предрасположенность к аутоиммунитету — чему мы научились? Семин. Иммунол. 2011; 23:67–83. [PubMed] [Google Scholar]
112. Форстер С. Сигнатуры интерферона при иммунных расстройствах и заболеваниях. Иммунол. Клеточная биол. 2012;90:520–527. [PubMed] [Google Scholar]
Иммунол. Клеточная биол. 2012;90:520–527. [PubMed] [Google Scholar]
113.
Телес юаней и др. Интерферон типа I подавляет антимикобактериальные реакции человека, запускаемые интерфероном типа II. Наука. 2013;339: 1448–1453. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вместе со ссылками 114–116 и 124–127 это исследование демонстрирует доминирующую супрессивную функцию IFN I типа при хронических инфекциях, опосредованную индукцией IL-10 и PDL1.
114. Berry MP, et al. Индуцируемая интерфероном нейтрофильная сигнатура транскрипции крови при туберкулезе человека. Природа. 2010; 466:973–977. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115. McNab FW, et al. Передача сигналов TPL-2-ERK1/2 способствует устойчивости хозяина к внутриклеточной бактериальной инфекции за счет негативной регуляции продукции IFN I типа. Дж. Иммунол. 2013;191: 1732–1743. [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. O’Garra A, et al. Иммунный ответ при туберкулезе. Анну. Преподобный Иммунол. 2013; 31: 475–527. [PubMed] [Google Scholar]
Преподобный Иммунол. 2013; 31: 475–527. [PubMed] [Google Scholar]
117. Каллиолиас Г.Д., Ивашкив Л.Б. Обзор биологии интерферонов I типа. Артрит Рез. тер. 2010;12(Приложение 1):S1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
118. Ивашкив Л.Б. PTPN22 при аутоиммунитете: другая клетка и другой путь. Иммунитет. 2013;39:91–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Wang Y, et al. Связанный с аутоиммунитетом ген PTPN22 потенцирует управляемый толл-подобными рецепторами интерферон-зависимый иммунитет 1-го типа. Иммунитет. 2013;39:111–122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
120. Prinz M, et al. Различные и неповторяющиеся in vivo функции IFNAR на миелоидных клетках ограничивают аутоиммунитет в центральной нервной системе. Иммунитет. 2008; 28: 675–686. [PubMed] [Google Scholar]
121. Cantaert T, Baeten D, Tak PP, van Baarsen LG. Перекрестная регуляция IFN I типа и TNF-альфа при иммуноопосредованном воспалительном заболевании: основные концепции и клиническая значимость. Артрит Рез. тер. 2010;12:219. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Артрит Рез. тер. 2010;12:219. [Бесплатная статья PMC] [PubMed] [Google Scholar]
122. Banchereau J, Pascual V, Palucka AK. Аутоиммунитет через цитокин-индуцированную активацию дендритных клеток. Иммунитет. 2004; 20: 539–550. [PubMed] [Google Scholar]
123. Гордон Р.А., Григорьев Г., Ли А., Каллиолиас Г.Д., Ивашкив Л.Б. Сигнатура интерферона и экспрессия STAT1 в макрофагах синовиальной жидкости при ревматоидном артрите индуцируются фактором некроза опухоли альфа и контррегулируются микроокружением синовиальной жидкости. Ревмирующий артрит. 2012;64:3119–3128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
124. Wilson EB, et al. Блокада хронической передачи сигналов интерферона типа I для контроля персистирующей инфекции LCMV. Наука. 2013; 340:202–207. [Бесплатная статья PMC] [PubMed] [Google Scholar]
125. Teijaro JR, et al. Персистирующая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука. 2013; 340:207–211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
126. Antonelli LR, et al. Интраназальное лечение Poly-IC усугубляет туберкулез у мышей за счет легочной вербовки популяции патоген-пермиссивных моноцитов/макрофагов. Дж. Клин. Инвестировать. 2010; 120:1674–1682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Antonelli LR, et al. Интраназальное лечение Poly-IC усугубляет туберкулез у мышей за счет легочной вербовки популяции патоген-пермиссивных моноцитов/макрофагов. Дж. Клин. Инвестировать. 2010; 120:1674–1682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
127. Mayer-Barber KD, et al. Врожденные и адаптивные интерфероны подавляют продукцию IL-1α и IL-1β различными легочными миелоидными субпопуляциями во время инфекции Mycobacterium tuberculosis . Иммунитет. 2011;35:1023–1034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
128. Su AI, et al. Геномный анализ ответа хозяина на инфекцию вирусом гепатита С. проц. Натл акад. науч. США. 2002; 99: 15669–15674. [Бесплатная статья PMC] [PubMed] [Google Scholar]
129. Guidotti LG, Chisari FV. Иммунобиология и патогенез вирусных гепатитов. Анну. Преподобный Патол. 2006; 1: 23–61. [PubMed] [Академия Google]
130. Кулпа Д.А., и соавт. Коингибирующие сигналы PD-1: связь между патогенезом и защитой. Семин. Иммунол. 2013;25:219–227. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иммунол. 2013;25:219–227. [Бесплатная статья PMC] [PubMed] [Google Scholar]
131. Hajishengallis G, Lambris JD. Микробные манипуляции с перекрестными помехами рецепторов при врожденном иммунитете. Природа Преподобный Иммунол. 2011; 11: 187–200. [Статья бесплатно PMC] [PubMed] [Google Scholar]
132. Maecker HT, McCoy JP, Nussenblatt R. Стандартизация иммунофенотипирования для проекта иммунологии человека. Природа Преподобный Иммунол. 2012;12:191–200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
133. Davis MM. Иммунология, которой учат люди. Научный перевод. Мед. 2012;4:117fs2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
134. Fung KY, et al. Интерферон-ε защищает женские половые пути от вирусных и бактериальных инфекций. Наука. 2013; 339:1088–1092. [Бесплатная статья PMC] [PubMed] [Google Scholar]
135. Wang H, et al. Роль киназы 3 гликогенсинтазы в регуляции IFN-β-опосредованной продукции IL-10. Дж. Иммунол. 2011; 186: 675–684. [Бесплатная статья PMC] [PubMed] [Google Scholar]
136.

 egrul.nalog.ru.
egrul.nalog.ru.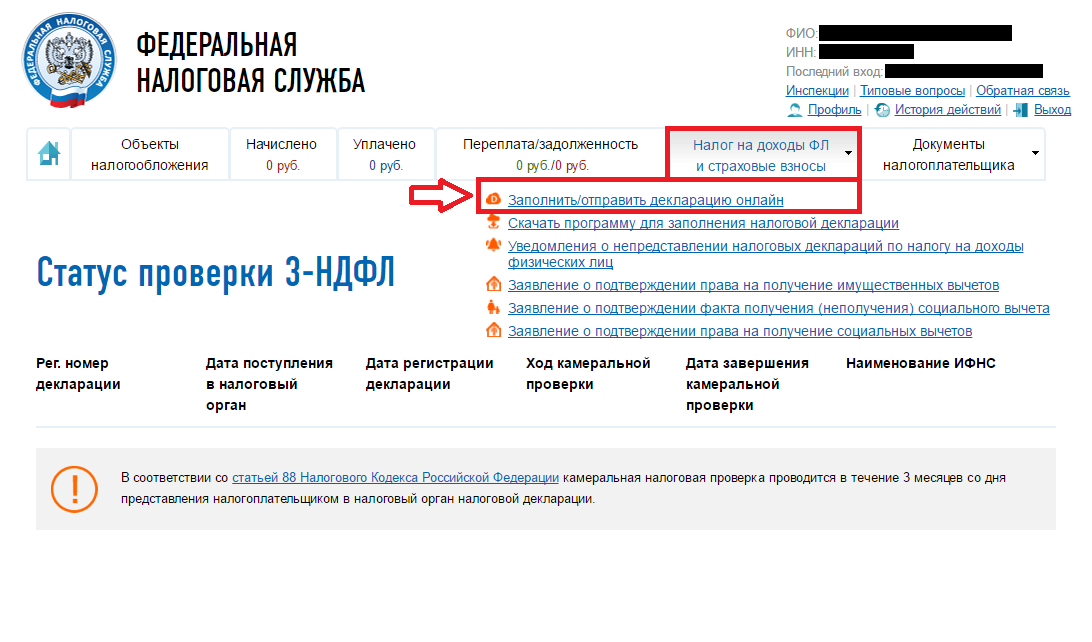 Данные справки отображают действительные реквизиты компании, данные об уставном капитале и дату регистрации контрагента в ЕГРЮЛ.
Данные справки отображают действительные реквизиты компании, данные об уставном капитале и дату регистрации контрагента в ЕГРЮЛ.
 д.)
д.) , Равера Р., Джоя Д., Гарильо М., Ландольфо С. (2002). «Система интерферона: обзор». Европейский журнал детской неврологии . 6 Приложение А (6): A41–6; обсуждение A55–8.
, Равера Р., Джоя Д., Гарильо М., Ландольфо С. (2002). «Система интерферона: обзор». Европейский журнал детской неврологии . 6 Приложение А (6): A41–6; обсуждение A55–8. Медицинский журнал Кливлендской клиники. 69 (2): 155–9.
Медицинский журнал Кливлендской клиники. 69 (2): 155–9.